Abiratérone
| Abiratérone | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| DCI | Abiratérone (acétate) | |
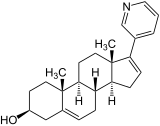
| Nom UICPA | (3β)-17-(pyridin-3-yl)androsta-5,16-dién-3-ol | |
| Synonymes |
Zytiga |
|
| No CAS | ||
| No ECHA | 100.241.170 | |
| Code ATC | ||
| DrugBank | DB05812 | |
| PubChem | 132971 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C24H31NO |
|
| Masse molaire[1] | 349,509 ± 0,021 9 g/mol C 82,48 %, H 8,94 %, N 4,01 %, O 4,58 %, |
|
| Données pharmacocinétiques | ||
| Biodisponibilité | n/a | |
| Liaison protéique | 99,8 % | |
| Métabolisme | hépatique | |
| Demi-vie d’élim. | environ 15 heures | |
| Excrétion |
Fécale (88 %), Urinaire (5 %) |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'acétate d'abiratérone (commercialisée en France sous le nom de Zytiga par le laboratoire Janssen) est un inhibiteur sélectif de la biosynthèse des androgènes indiqué dans le traitement du cancer métastatique de la prostate résistant à la castration (CPRCm). Il est administré de façon continue par voie orale en une seule prise par jour, à distance des repas, à la dose de 1 000 mg par jour soit quatre comprimés, en association avec des corticoïdes, la prednisone ou la prednisolone, à la dose de 5 mg deux fois par jour.
L’acétate d’abiratérone a obtenu sa première autorisation de mise sur le marché (AMM) le chez les hommes adultes CPRCm dont la maladie a progressé pendant ou après une chimiothérapie à base de Docétaxel[2].
Le , l’EMA (European Medicines Agency) a validé une extension d’AMM de l’acétate d’abiratérone dans le traitement du cancer métastatique de la prostate résistant à la castration chez les hommes adultes asymptomatiques ou peu symptomatiques, après échec d’un traitement par suppression androgénique et pour lesquels la chimiothérapie n’est pas encore cliniquement indiquée[3].
Historique modifier
La molécule d’acétate d’abiratérone a été initialement découverte en 1990 dans un centre de recherche à Londres (Institute of Cancer Research) par le Docteur Gerry Potter[4]. Le brevet fut déposé en 1994 par la société British Technology Group (BTG plc). BTG a ensuite concédé la licence de la molécule à la société Cougar Biotechnology en 2004 qui a ensuite initié le développement commercial du produit[5]. En 2009, la société Cougar Biotechnology a été acquise par la société Johnson & Johnson, dont l’entité pharmaceutique Janssen mène actuellement la commercialisation et les essais cliniques du produit.
Mécanisme d'action modifier
L’acétate d’abiratérone est le seul inhibiteur de la biosynthèse des androgènes disponible actuellement sur le marché ciblant spécifiquement le CYP17A1[6],[7].
Cette molécule inhibe l’activité du complexe enzymatique 17 α-hydroxylase/C17-20-lyase (CYP17) permettant d’une part un blocage de la biosynthèse des androgènes testiculaires et surrénaliens, agissant sur la composante extratumorale de cette synthèse, et d’autre part, un blocage de la biosynthèse des androgènes dans la cellule tumorale elle-même, agissant donc aussi sur la composante intratumorale[5],[8]. Ce mécanisme d’action est intéressant puisque le cancer de la prostate métastatique résistant à la castration est hormono-sensible : la tumeur synthétise les androgènes dont elle a besoin pour stimuler sa propre croissance[8].
Pharmacocinétique modifier
L'acétate d’abiratérone est rapidement transformé in vivo en abiratérone, un inhibiteur de la biosynthèse des androgènes[9]. La concentration plasmatique maximale d'acétate d’abiratérone est atteinte environ 2 heures après l'administration orale à jeun. Comparé à une administration à jeun, l'administration d’acétate d’abiratérone avec la nourriture entraîne une augmentation de l’exposition systémique moyenne à l'abiratérone jusqu’à 10 fois pour l'aire sous la courbe et jusqu’à 17 fois pour la concentration maximale, en fonction de la teneur en graisses des aliments. En raison de la variabilité normale du contenu et de la composition des repas, la prise de ce médicament avec les repas peut entraîner des degrés d’exposition très variables. Ainsi, l'acétate d’abiratérone ne doit pas être pris avec de la nourriture. Il doit être pris au moins deux heures après le repas et aucun aliment ne doit être ingéré pendant au moins une heure après la prise.
Dans le plasma humain, la fixation protéique de la 14C-abiratérone est de 99,8 %.
Après administration orale, l’abiratérone est éliminé par plusieurs mécanismes dont la sulfatation, l'hydroxylation et l'oxydation, principalement au niveau du foie.
Cette molécule est excrétée à 88 % dans les selles et à 5 % dans les urines.
D'après les données recueillies chez les sujets sains, la demi-vie plasmatique moyenne de l'abiratérone est d'environ 15 heures.
Études cliniques modifier
L'acétate d’abiratérone en association avec la prednisone ou la prednisolone améliore de façon significative la survie globale en augmentant la médiane de survie des patients atteints d’un (CPRCm), dont la maladie avait progressé après une chimiothérapie par Docétaxel[10]. L’analyse finale a démontré une augmentation de la médiane de survie de façon significative de 4,6 mois[10]. D’autre part, cet allongement de la médiane de survie s’est accompagné d’une amélioration significative du taux de réponse PSA de 38,5 % (versus 10,1 % dans le bras placebo plus prednisone, p = 0,0001), du temps jusqu’à progression du PSA (10,2 mois versus 6,6 mois dans le bras placebo plus prednisone, p < 0,0001), et de la survie médiane sans progression radiologique (5,6 mois versus 3,6 mois dans le bras placebo plus prednisone, p < 0,0001)[10].
Des réactions indésirables liées à l'augmentation des minéralocorticoides, conséquences pharmacodynamiques du mécanisme d'action de l’acétate d’abiratérone, ont été observées chez moins de 5 % des patients : l’hypokaliémie, l’hypertension et la rétention hydrique[10]. L'administration concomitante d'un corticoïde réduit l'incidence et la gravité de ces effets indésirables[10].
Également, l’étude menée chez les patients CPRCm asymptomatiques ou peu symptomatiques, et naïfs de chimiothérapie[11] a montré dans la 3e analyse intermédiaire (réalisée après la survenue de 56 % des décès, et un suivi median de 27,1 mois) que l'acétate d’abiratérone plus prednisone a amélioré significativement la survie sans progression radiologique (HR = 0,53 (IC 95 % : 0,45-0,62) ; p < 0,0001) en réduisant le risque de 47 %. La survie globale médiane a aussi été augmentée notablement (HR=0,79 (IC 95 % : 0,66-0,95) p = 0,0151) avec une diminution du risque de décès de 21 % dans le bras acétate d’abiratérone comparé au bras placebo plus prednisone.
Les critères secondaires (délai jusqu’à utilisation des opiacés, délai jusqu’à initiation de la chimiothérapie, délai jusqu’à détérioration du score ECOG, temps jusqu’à progression du PSA), comme les critères exploratoires de qualité de vie (temps jusqu’à l’augmentation de la douleur, temps jusqu’au déclin de l’état fonctionnel) ont tous été améliorés de façon significative dans le bras acétate d’abiratérone plus prednisone par rapport au bras placebo plus prednisone.
Concernant le profil de tolérance, cette étude n’a pas mise en évidence de nouveaux signaux de pharmacovigilance avec une exposition au traitement plus longue.
Réglementation modifier
L'acétate d'abiratérone est accessible dans les pharmacies d’officine, car inscrit sur la liste des médicaments remboursables en France, pour l’indication en post chimiothérapie, au JORF no 0142 du page 10214 texte no 15. Selon l'arrêté du , publié au Journal officiel du , la prise en charge est étendue au traitement du cancer métastatique de la prostate résistant à la castration, en association avec la prednisone ou la prednisolone, chez les hommes adultes asymptomatiques ou peu symptomatiques, après échec d'un traitement par suppression androgénique et pour lesquels la chimiothérapie n'est pas encore cliniquement indiquée. En conséquence, l'acétate d’abiratérone est désormais remboursable dans toutes les indications validées par l'autorisation de mise sur le marché.Le taux de remboursement est de 100 %.
Références modifier
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Site AFFSAPS : http://www.afssaps.fr/Infos-de-securite/Communiques-Points-presse/Point-d-information-sur-les-dossiers-discutes-en-commission-d-AMM-Seance-du-jeudi-15-septembre-2011-Communique/(language)/fre-FR
- (en) « Public Health - European Commission », sur Union Register of medicinal products (consulté le ).
- Arney K (2009-05-26) « New results for prostate cancer drug abiraterone » Science Update blog. Cancer Research UK. Consulté le 4 septembre 2011
- « Abiraterone Acetate (CB7630). Research and Development Pipeline » Cougar Biotechnology, Inc. Consulté le 20 août 2008.
- fiche substance fournie par le dictionnaire Vidal
- liste des médicaments contenant la substance fournie par le dictionnaire Vidal
- (en) Attard G et al. « Selective blockade of androgenic steroid synthesis by novel lyase inhibitors as a therapeutic strategy for treating metastatic prostate cancer » BJU Int. 2005;96:1241-6
- Site de l’EMA (European Medicines Agency)http://www.ema.europa.eu/docs/fr_FR/document_library/EPAR__Product_Information/human/002321/WC500112858.pdf
- 10 (en) Fizazi K et al. « Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study » Lancet Oncol. 2012;13:983-92.
- D’après la communication orale de Rathkopf DE. (en) « Updated interim analysis (IA) of COU-AA-302, a randomized phase III study of abiraterone acetate (AA) in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) without prior chemotherapy ». Abstract # 5, 2013 Genitourinary Cancers Symposium
Liens externes modifier
- Compendium suisse des médicaments : spécialités contenant Abiratérone