2-Phényléthylamine
| Phényléthylamine | |
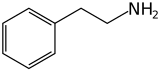
| |
| Structure de la phényléthylamine. | |
| Identification | |
|---|---|
| Nom UICPA | 2-phényléthanamine ou α-desméthylamphétamine |
| No CAS | |
| No ECHA | 100.000.523 |
| No CE | 200-574-4 |
| PubChem | |
| FEMA | 3220 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C8H11N [Isomères] |
| Masse molaire[1] | 121,179 6 ± 0,007 4 g/mol C 79,29 %, H 9,15 %, N 11,56 %, |
| Propriétés physiques | |
| T° fusion | −60 °C[2] |
| T° ébullition | 200 °C[2] |
| Masse volumique | 0,965 g cm−3[3] |
| Point d’éclair | 81 °C[2] |
| Précautions | |
| SGH | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La 2-phényléthylamine, β-phényléthylamine ou plus simplement phényléthylamine ou phénéthylamine (PEA) est un composé organique de formule C6H5C2H4NH2, constitué d'un groupe éthyle substitué par un groupe amine d'un côté, et par un groupe phényle de l'autre. C'est l'un des deux isomères de la phényléthylamine.
C'est un alcaloïde monoaminé agissant comme stimulant du système nerveux central chez l'humain. Dans le cerveau, elle régule la neurotransmission des monoamines en se liant aux récepteurs associés à une amine de trace de type 1 (TAAR1 (en)) et en inhibant les transporteurs vésiculaire des monoamines 2 (VMAT2)[4],[5],[6] ; à un niveau moindre, elle agit également comme neurotransmetteur dans le système nerveux central[7].
Chez les mammifères. la phényléthylamine est produite par décarboxylation enzymatique de la L-phénylalanine par l'action de l'enzyme acide L-aminé aromatique décarboxylase[8]. En plus de sa présence chez les mammifères, on la trouve dans d'autres types d'organismes et de source de nourriture, comme le chocolat.
Les phényléthylamines, ou plus précisément les phényléthylamines substituées, sont une famille de dérivés de la phényléthylamine. On y inclut les amphétamines substituées, les méthylènedioxyphénéthylamines substituées (MDxx).
-
PEA sous fome de poudre.
-
PEA sous fome de cristaux.
Notes et références modifier
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Phenethylamine », sur ChemSpider (consulté le ).
- « Phenethylamine », sur Sigma Aldrich (consulté le ).
- Pei Y., Asif-Malik A. et Canales J.J., « Trace Amines and the Trace Amine-Associated Receptor 1: Pharmacology, Neurochemistry, and Clinical Implications », Front. Neurosci., vol. 10, , p. 148 (PMID 27092049, PMCID 4820462, DOI 10.3389/fnins.2016.00148).
- Wimalasena K., « Vesicular monoamine transporters: structure-function, pharmacology, and medicinal chemistry », Med. Res. Rev., vol. 31, no 4, , p. 483–519 (PMID 20135628, PMCID 3019297, DOI 10.1002/med.20187).
- Miller G.M., « The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity », J. Neurochem., vol. 116, no 2, , p. 164–176 (PMID 21073468, PMCID 3005101, DOI 10.1111/j.1471-4159.2010.07109.x).
- H.C. Sabelli, A.D. Mosnaim, A.J. Vazquez, W.J. Giardina, R.L. Borison et W.A. Pedemonte, « Biochemical plasticity of synaptic transmission: A critical review of Dale's Principle », Biological Psychiatry, vol. 11, no 4, , p. 481-524 (PMID 9160).
- M.D. Berry, « Mammalian central nervous system trace amines. Pharmacologic amphetamines, physiologic neuromodulators. », Journal of Neurochemistry, vol. 90, no 2, , p. 257–71 (PMID 15228583, DOI 10.1111/j.1471-4159.2004.02501.x).



