Vimentine
La vimentine est une protéine, membre de la famille des filaments intermédiaires. Les filaments intermédiaires sont des protéines structurelles importantes des cellules eucaryotes. Ils constituent, avec les microtubules et les microfilaments d'actine, le cytosquelette. Bien que la plupart des filaments intermédiaires soient des structures stables, dans les fibroblastes, la vimentine est une structure dynamique.
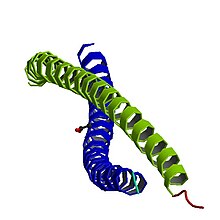
Structure modifier
Un monomère de vimentine, comme tous les autres filaments intermédiaires, a un domaine en hélice alpha, avec à chaque extrémité des têtes aminées non-hélicoïdales et des queues carboxylées[1]. Les deux monomères tournent l'un autour de l'autre pour former un dimère bispiralé. Deux dimères forment un tétramère, qui, à son tour, forme une feuille en interagissant avec d'autres tétramères.
La séquence de l'hélice α contient des acides aminés hydrophobes qui contribuent à la formation d'un "sceau hydrophobe" sur la surface de l'hélice[1]. Ce sceau permet aux deux hélices de se réunir et de former une bobine. En outre, il existe une répartition périodique des acides aminés de base qui semble jouer un rôle important dans la stabilisation des dimères bispiralés[1]. L'espacement des résidus est optimal pour la formation de ponts salins (en), qui permettent de stabiliser la structure de l'hélice α. Même si ce type de stabilisation est intuitive pour des interactions intra-chaînes, plutôt que des interactions inter-chaînes, les scientifiques ont proposé que peut-être le passage de ponts salins intra-chaînes formés par les résidus acides et basiques à des interactions ioniques inter-chaînes contribue à l'assemblage du filament[1].
Fonction modifier
Les scientifiques ont constaté que la vimentine est jointe au noyau, au réticulum endoplasmique, et aux mitochondries, que ce soit par sa partie latérale ou terminale[2]. Ils en ont conclu que la vimentine joue un rôle important dans le soutien et l'ancrage de la position des organites dans le cytoplasme.
La nature dynamique de la vimentine est importante car elle offre de la flexibilité à la cellule. Il est admis que la vimentine est le composant chargé de maintenir l'intégrité des cellules. (Il a été constaté que les cellules sans vimentine sont extrêmement délicates face à des stress particuliers.)[3]
Le résultat d'une étude portant sur des souris transgéniques qui n'ont pas de vimentine[3] a montré que les souris étaient fonctionnellement normales. Bien que le résultat puisse paraître surprenant, il est possible que le réseau de microtubules ait compensé l'absence de réseau intermédiaire. Cela renforce l'idée de l'interaction intime entre les microtubules et la vimentine. En outre, lorsque des protéines de dépolymérisation des microtubules étaient présentes, la vimentine se réorganisait, impliquant une fois de plus une relation entre les deux systèmes[3].
La vimentine est donc responsable du maintien de la forme cellulaire, de l'intégrité du cytoplasme, et stabilise les interactions cytosquelettiques.
En outre, la vimentine permet de contrôler le transport des lipoprotéines de basse densité, le LDL-cholestérol provenant d'un lysosome sur un site d'estérification[4]. Avec un blocage du transport du LDL-cholestérol à l'intérieur de la cellule, on a constaté que les cellules stockaient un pourcentage beaucoup plus faible de la lipoprotéine comparé aux cellules normales avec de la vimentine. Cette dépendance semble être la première d'un processus biochimique. Ce type de dépendance a des répercussions sur les cellules surrénales, qui s'appuient sur des dérivés d'esters de LDL cholestérol[4].
Notes et références modifier
- (en) Fuchs E., Weber K., « Intermediate filaments: structure, dynamics, function, and disease », Annu Rev Biochem, vol. 63, , pp. 345–82 (PMID 7979242, DOI 10.1146/annurev.bi.63.070194.002021)
- (en) Katsumoto T., Mitsushima A., Kurimura T., « The role of the vimentin intermediate filaments in rat 3Y1 cells elucidated by immunoelectron microscopy and computer-graphic reconstruction », Biol Cell, vol. 68, no 2, , pp. 139–46 (PMID 2192768, DOI 10.1016/0248-4900(90)90299-I)
- (en) Goldman R. D., Khuon S., Chou Y., Opal P., Steinert P., « The function of intermediate filaments in cell shape and cytoskeletal integrity », J Cell Biol, vol. 134, no 4, , pp. 971–83 (PMID 8769421, DOI 10.1083/jcb.134.4.971)
- (en) Sarria A. J., Panini S. R., Evans R. M., « A functional role for vimentin intermediate filaments in the metabolism of lipoprotein-derived cholesterol in human SW-13 cells », J Biol Chem, vol. 267, no 27, , pp. 19455–63 (PMID 1527066)