Variation clinale
Une variation clinale (de l'anglais ring species, « espèce en anneau », parfois traduit en « cercle de population » de l'allemand Rassenkreis de Bernhard Rensch) est une série de populations voisines connectées dont les populations relativement apparentées peuvent se reproduire entre elles, mais au sein de laquelle il existe au moins deux populations « terminales » qui sont trop peu apparentées pour qu'il y ait inter-reproduction. C'est un cas particulier de cline systématique[1].
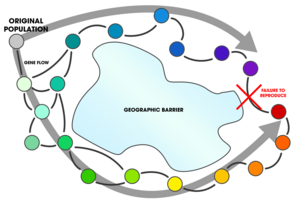

Ainsi, des populations qui ne se reproduisent pas entre elles restent génétiquement connectées par le biais de populations apparentées intermédiaires. Il arrive que ces populations « terminales » coexistent dans une même région géographique, amenant la série de populations connectées à former un « anneau ».
Ce qui empêche ces populations terminales de former deux espèces distinctes est l'existence de populations intermédiaires qui les relient génétiquement. Si suffisamment de populations intermédiaires s'éteignent au fil du temps pour rompre la reproduction indirecte entre les populations terminales, la variation clinale aboutit à la formation de deux espèces distinctes[2].
La variation clinale est un type de spéciation par distance, elle illustre ce qui se passe au fil du temps lorsque des populations divergent génétiquement mais représente un cas particulier dans le sens où elle montre sur des populations en vie ce qui se déroule habituellement entre des populations ancestrales depuis longtemps éteintes et des populations en vie. La variation clinale est un exemple pratique de la difficulté à définir précisément les critères du concept d'espèce, même en se limitant à une définition simplifiée fondée sur l'interfécondité.
Histoire modifier
-
Les goélands du genre Larus se croisent dans un cercle qui fait le tour de l'Arctique. 1 = L. fuscus ; 2 = Population sibérienne de L. fuscus ; 3 = L. heuglini ; 4 = L. vegae birulai ; 5 = L. vegae ; 6 = L. smithsonianus ; 7 = L. argentatus.
-
Goéland argenté (Larus argentatus, devant) et goéland brun (Larus fuscus, derrière) en Norvège : deux phénotypes avec de nettes différences.
L'espèce annulaire la plus typique est le goéland du genre Larus. En 1925, Jonathan Dwight a découvert que ce genre forme une chaîne de variétés autour du cercle arctique. Cependant, des doutes sont apparus quant à savoir s'il s'agit d'une véritable espèce annulaire[3]. En 1938, Claud Buchanan Ticehurst soutenait que le pouillot verdâtre s'était répandu du Népal autour du plateau tibétain, tout en s'adaptant à chaque nouvel environnement, se retrouvant ainsi en Sibérie où les extrémités de l'anneau ne se croisent plus[4]. Ces découvertes et d'autres encore ont conduit Mayr à formuler pour la première fois une théorie sur les espèces annulaires dans son étude de 1942 intitulée Systematics and the Origin of Species. Toujours dans les années 1940, Robert C. Stebbins a décrit les salamandres du genre Ensatina autour de la Central Valley californienne comme appartenant à une espèce annulaire[5],[6], mais là encore, certains auteurs comme Jerry Coyne considèrent que cette classification est incorrecte[7]. Enfin, en 2012, le premier exemple d'une espèce annulaire chez les plantes a été trouvé chez un euphorbe, dont les individus se croisent dans un anneau faisant le tour de la mer des Caraïbes[8].
Spéciation modifier
Le biologiste Ernst Mayr a défendu le concept d'espèces annulaires, affirmant qu'il démontrait sans équivoque le processus de spéciation[9]. Une espèce annulaire est un modèle alternatif à la spéciation allopatrique, « illustrant comment de nouvelles espèces peuvent apparaître par "chevauchement circulaire", sans interruption du flux de gènes dans les populations intermédiaires [...]. »[10] Cependant, Jerry Coyne et H. Allen Orr soulignent que les espèces annulaires modèlent plus étroitement le processus de spéciation parapatrique[7].
Les espèces annulaires attirent souvent les intérêts des biologistes de l'évolution, des systématiciens et des chercheurs en spéciation, ce qui conduit à des idées qui provoquent à la fois la réflexion et la confusion concernant leur définition[1]. Les spécialistes contemporains reconnaissent que les exemples retrouvés dans la nature se sont avérés rares en raison de divers facteurs tels que les limites de la délimitation taxonomique[11] ou le « zèle taxonomique »[9] — ce qui s'explique par le fait que les taxonomistes classent les organismes en "espèces", alors que les espèces annulaires ne peuvent souvent pas correspondre à cette définition[1]. D'autres raisons, telles que l'interruption du flux génétique due à la "divergence des vicariés" et la fragmentation des populations en raison de l'instabilité du climat, ont également été citées[9].
Les espèces annulaires présentent également un cas intéressant du problème des espèces pour ceux qui cherchent à diviser le monde vivant en espèces discrètes. Tout ce qui distingue une espèce annulaire de deux espèces distinctes est l'existence de populations qui se connectent ; si suffisamment de populations de l'anneau périssent pour rompre le lien de reproduction, alors les populations distales de l'anneau seront reconnues comme deux espèces distinctes. Le problème est de savoir s'il faut quantifier l'ensemble des individus de l'anneau comme appartenant à une seule espèce (bien que tous les individus ne puissent pas se croiser) ou classer chaque population comme une espèce distincte (bien qu'elle puisse se croiser avec ses proches voisins). Les espèces annulaires illustrent le fait que les frontières entre les espèces apparaissent progressivement et qu'elles existent souvent sur un continuum[9].
Exemples modifier
De nombreux exemples ont été documentés dans la nature. La plupart des recherches font l'objet d'un débat, certains auteurs citant des preuves remettant en cause leur existence même[7],[12]. Les exemples suivants prouvent que, malgré le nombre limité d'exemples concrets et idéalisés dans la nature, il existe des continuums d'espèces et qu'on peut les trouver dans les systèmes biologiques[9]. Ces derniers sont souvent caractérisés par des classifications au niveau des sous-espèces telles que les clines, les écotypes, les complexes d'espèces et les variétés. Parmi ces exemples, de nombreux ont été contestés par les chercheurs, et de même, « de nombreux cas [proposés] ont reçu très peu d'attention de la part des chercheurs, ce qui rend difficile d'évaluer s'ils présentent les caractéristiques d'une espèce annulaire idéale. »[1]
La liste suivante donne des exemples d'espèces annulaires que l'on trouve dans la nature. Certains exemples, tels que le complexe des goélands du genre Larus, le Pouillot verdâtre d'Asie et les salamandres du genre Ensatina d'Amérique, ont été contestés[12],[13],[3],[14].
- Acanthiza pusilla et A. ewingii[15]
- Acacia karroo[1],[16],[17]
- Alouettes du genre Alauda (Alauda arvensis, A. japonica et A. gulgula)[1]
- Alophoixus[9],[18]
- Aulostomus (poisson-trompette)[19]
- Camarhynchus psittacula et C. pauper[1]
- Chaerephon pumilus (complexe d'espèces)[20]
- salamandres du genre Ensatina[21]
- Euphorbia tithymaloides est un groupe de la famille des Euphorbiaceae qui s'est reproduit et a évolué en anneau à travers l'Amérique centrale et les Caraïbes, se réunissant dans les îles Vierges où ils semblent être morphologiquement et écologiquement distincts[8]
- Mésange charbonnière[1] (cependant, certaines études contestent cet exemple[22],[23])
- le pouillot verdâtre (Phylloscopus trochiloides) forme une espèce annulaire autour du plateau de l'Himalaya[24],[25],[26],[13]. On pense qu'il s'est répandu du Népal autour de l'inhospitalier plateau tibétain, pour rejoindre la Sibérie, où les sous-espèces plumbeitarsus et viridanus semblent ne plus se reproduire mutuellement.
- Hoplitis producta[1]
- souris domestique[1]
- Junonia coenia et J. genoveva/J. evarete[1]
- Lalage leucopygialis, L. nigra, et L. sueurii[1]
- les goélands du genre Larus forment un "anneau" circumpolaire autour du pôle Nord. Le goéland argenté européen (L. argentatus argenteus), qui vit principalement en Grande-Bretagne et en Irlande, peut s'hybrider avec le goéland argenté américain (L. smithsonianus), vivant en Amérique du Nord, ainsi qu'avec le goéland argenté de Vega ou de Sibérie orientale (L. vegae), dont la sous-espèce occidentale, le goéland de Birula (L. vegae birulai), peut s'hybrider avec le goéland de Heuglin (L. heuglini), qui à son tour peut s'hybrider avec le goéland brun (L. fuscus). Tous les quatre vivent dans le nord de la Sibérie. Le dernier cité est le représentant oriental des goélands marins du nord-ouest de l'Europe, y compris la Grande-Bretagne. Les goélands marins et les goélands argentés sont suffisamment différents pour ne pas pouvoir s'hybrider en théorie ; le groupe de goélands forme donc un continuum, sauf là où les deux lignées se rencontrent en Europe. Cependant, une étude génétique de 2004 intitulée "Le complexe du goéland argenté n'est pas une espèce annulaire" a montré que cet exemple est bien plus compliqué que celui présenté ici[3]. Cet exemple ne concerne que le complexe d'espèces allant du goéland argenté classique au goéland marin. Il existe plusieurs autres exemples taxonomiquement peu clairs qui appartiennent au même complexe d'espèces, tels que le goéland leucophée (L. michahellis), le goéland bourgmestre (L. hyperboreus) et le goéland caspien (L. cachinnans).
- Pelophylax nigromaculatus et P. porosus / P. porosus brevipodus[1] (les noms et la classification de ces espèces ont changé depuis la publication suggérant une espèce annulaire)
- Pernis ptilorhynchus et P. celebensis[1]
- Perognathus amplus et P. longimembris[1]
- Peromyscus maniculatus[27]
- Phellinus[28]
- Platycercus elegans (complexe d'espèces)[29],[30]
- Drosophila paulistorum[31]
- Phylloscopus collybita et P. sindianus[1]
- Phylloscopus (les pouillots)[32],[33]
- Powelliphanta[34]
- Rhymogona silvatica et R. cervina[1] (les noms et la classification de ces espèces ont changé depuis la publication suggérant une espèce annulaire)
- Melospiza melodia, le Bruant chanteur, forme un anneau autour de la Sierra Nevada de Californie[35] où se rencontrent les sous-espèces heermanni et fallax aux alentours du col de San Gorgonio
- Todiramphus chloris et T. cinnamominus[1]
Voir aussi modifier
Notes modifier
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ring species » (voir la liste des auteurs).
Références modifier
- D. E. Irwin, J. H. Irwin et T. D. Price, « Ring species as bridges between microevolution and speciation », Genetica, vol. 112-113, , p. 223–243 (ISSN 0016-6707, PMID 11838767, lire en ligne, consulté le )
- Richard Dawkins, The Ancestor's Tale, Houghton Mifflin, (ISBN 0-618-00583-8), p. 303
- Dorit Liebers, Peter de Knijff et Andreas J. Helbig, « The herring gull complex is not a ring species », Proceedings. Biological Sciences, vol. 271, no 1542, , p. 893–901 (ISSN 0962-8452, PMID 15255043, PMCID 1691675, DOI 10.1098/rspb.2004.2679, lire en ligne, consulté le )
- Darren Irwin, « Greenish warblers », sur www.zoology.ubc.ca (consulté le )
- « A closer look at a classic ring species: The work of Tom Devitt », sur evolution.berkeley.edu (consulté le )
- (en) Richard Dawkins et Yan Wong, The Ancestor's Tale : A Pilgrimage to the Dawn of Evolution, Houghton Mifflin Harcourt, , 673 p. (ISBN 978-0-618-61916-0, lire en ligne)
- Jerry A. Coyne & H. Allen Orr, (2004). Speciation, Sinauer Associates, , 545 p. (ISBN 0-87893-091-4), p. 102–105
- N. Ivalú Cacho et David A. Baum, « The Caribbean slipper spurge Euphorbia tithymaloides: the first example of a ring species in plants », Proceedings. Biological Sciences, vol. 279, no 1742, , p. 3377–3383 (ISSN 1471-2954, PMID 22696529, PMCID 3396892, DOI 10.1098/rspb.2012.0498, lire en ligne, consulté le )
- Ricardo J. Pereira et David B. Wake, « Ring species as demonstrations of the continuum of species formation », Molecular Ecology, vol. 24, no 21, , p. 5312–5314 (ISSN 1365-294X, PMID 26509692, DOI 10.1111/mec.13412, lire en ligne, consulté le )
- A. J. Helbig, « Evolutionary genetics: a ring of species », Heredity, vol. 95, no 2, , p. 113–114 (ISSN 0018-067X, PMID 15999143, DOI 10.1038/sj.hdy.6800679, lire en ligne, consulté le )
- Darren E. Irwin, « A novel approach for finding ring species: look for barriers rather than rings », BMC biology, vol. 10, , p. 21 (ISSN 1741-7007, PMID 22410355, PMCID 3299606, DOI 10.1186/1741-7007-10-21, lire en ligne, consulté le )
- (en) Jerry Coyne, « There are no ring species », sur Why Evolution Is True, (consulté le )
- Miguel Alcaide, Elizabeth S. C. Scordato, Trevor D. Price et Darren E. Irwin, « Genomic divergence in a ring species complex », Nature, vol. 511, no 7507, , p. 83–85 (ISSN 1476-4687, PMID 24870239, DOI 10.1038/nature13285, lire en ligne, consulté le )
- Richard Highton, « Is Ensatina eschscholtzii a Ring-Species? », Herpetologica, vol. 54, no 2, , p. 254–278 (ISSN 0018-0831, lire en ligne, consulté le )
- K. Simpson, N. Day & P. Trusler, (1999), Birds of Australia (6 ed.),, Princeton University Press, , 6e éd.
- (en) P. Brain, « Genetic races in a ring species Acacia karoo », South African Journal of Science, vol. 85, no 3, , p. 181 (ISSN 0038-2353 et 1996-7489, lire en ligne, consulté le )
- (en) David Ward, « Population differentiation in a purported ring species, Acacia karroo (Mimosoideae) », Biological Journal of the Linnean Society, vol. 104, no 4, , p. 748–755 (ISSN 0024-4066, DOI 10.1111/j.1095-8312.2011.01757.x, lire en ligne, consulté le )
- Jérôme Fuchs, Per G. P. Ericson, Céline Bonillo et Arnaud Couloux, « The complex phylogeography of the Indo-Malayan Alophoixus bulbuls with the description of a putative new ring species complex », Molecular Ecology, vol. 24, no 21, , p. 5460–5474 (ISSN 1365-294X, PMID 26224534, DOI 10.1111/mec.13337, lire en ligne, consulté le )
- (en) B. W. Bowen, A. L. Bass, L. A. Rocha et W. S. Grant, « Phylogeography of the Trumpetfishes (aulostomus): Ring Species Complex on a Global Scale », Evolution, vol. 55, no 5, , p. 1029–1039 (ISSN 1558-5646, DOI 10.1111/j.0014-3820.2001.tb00619.x, lire en ligne, consulté le )
- (en) Theshnie Naidoo, Steven M. Goodman, M. Corrie Schoeman et Peter J. Taylor, « Partial support for the classical ring species hypothesis in the Chaerephon pumilus species complex (Chiroptera: Molossidae) from southeastern Africa and western Indian Ocean islands », Mammalia, vol. 80, no 6, , p. 627–643 (ISSN 1864-1547 et 0025-1461, DOI 10.1515/mammalia-2015-0062, lire en ligne, consulté le )
- (en) Craig Moritz, Christopher J. Schneider et David B. Wake, « Evolutionary Relationships Within the Ensatina Eschscholtzii Complex Confirm the Ring Species Interpretation », Systematic Biology, vol. 41, no 3, , p. 273–291 (ISSN 1063-5157, DOI 10.1093/sysbio/41.3.273, lire en ligne, consulté le )
- (en) Martin Päckert, Jochen Martens, Siegfried Eck et Alexander A. Nazarenko, « The great tit (Parus major) — a misclassified ring species », Biological Journal of the Linnean Society, vol. 86, no 2, , p. 153–174 (ISSN 0024-4066, DOI 10.1111/j.1095-8312.2005.00529.x, lire en ligne, consulté le )
- Laura Kvist, Jochen Martens, Hiroyoshi Higuchi et Alexander A. Nazarenko, « Evolution and genetic structure of the great tit (Parus major) complex », Proceedings. Biological Sciences, vol. 270, no 1523, , p. 1447–1454 (ISSN 0962-8452, PMID 12965008, PMCID 1691391, DOI 10.1098/rspb.2002.2321, lire en ligne, consulté le )
- P. Alström, « Species concepts and their application: insights from the genera Seicercus and Phylloscopus », Acta Zool. Sinica, vol. 52, , p. 429
- Darren E. Irwin, Staffan Bensch, Jessica H. Irwin et Trevor D. Price, « Speciation by distance in a ring species », Science (New York, N.Y.), vol. 307, no 5708, , p. 414–416 (ISSN 1095-9203, PMID 15662011, DOI 10.1126/science.1105201, lire en ligne, consulté le )
- D. E. Irwin, « Song variation in an avian ring species », Evolution; International Journal of Organic Evolution, vol. 54, no 3, , p. 998–1010 (ISSN 0014-3820, PMID 10937272, DOI 10.1111/j.0014-3820.2000.tb00099.x, lire en ligne, consulté le )
- (en) William Caire et Earl G. Zimmerman, « Chromosomal and Morphological Variation and Circular Overlap in the Deer Mouse, Peromyscus Maniculatus, in Texas and Oklahoma », Systematic Biology, vol. 24, no 1, , p. 89–95 (ISSN 1063-5157, DOI 10.1093/sysbio/24.1.89, lire en ligne, consulté le )
- (en) Erast Parmasto, « Phellinus laevigatus s. l. (Hymenochaetales): a ring species », Folia Cryptogamica Estonica, vol. 43, , p. 39–49 (ISSN 1736-7786, lire en ligne, consulté le )
- Leo Joseph, Gaynor Dolman, Stephen Donnellan et Kathleen M. Saint, « Where and when does a ring start and end? Testing the ring-species hypothesis in a species complex of Australian parrots », Proceedings. Biological Sciences, vol. 275, no 1650, , p. 2431–2440 (ISSN 0962-8452, PMID 18664434, PMCID 2603204, DOI 10.1098/rspb.2008.0765, lire en ligne, consulté le )
- Justin R. Eastwood, Mathew L. Berg, Raoul F. H. Ribot et Shane R. Raidal, « Phylogenetic analysis of beak and feather disease virus across a host ring-species complex », Proceedings of the National Academy of Sciences of the United States of America, vol. 111, no 39, , p. 14153–14158 (ISSN 1091-6490, PMID 25225394, PMCID 4191811, DOI 10.1073/pnas.1403255111, lire en ligne, consulté le )
- T. Dobzhansky et B. Spassky, « DROSOPHILA PAULISTORUM, A CLUSTER OF SPECIES IN STATU NASCENDI », Proceedings of the National Academy of Sciences of the United States of America, vol. 45, no 3, , p. 419–428 (ISSN 0027-8424, PMID 16590403, DOI 10.1073/pnas.45.3.419, lire en ligne, consulté le )
- Staffan Bensch, Mats Grahn, Nils Müller et Laurene Gay, « Genetic, morphological, and feather isotope variation of migratory willow warblers show gradual divergence in a ring », Molecular Ecology, vol. 18, no 14, , p. 3087–3096 (ISSN 1365-294X, PMID 19457197, DOI 10.1111/j.1365-294X.2009.04210.x, lire en ligne, consulté le )
- Darren E. Irwin, « Incipient ring speciation revealed by a migratory divide », Molecular Ecology, vol. 18, no 14, , p. 2923–2925 (ISSN 1365-294X, PMID 19457189, DOI 10.1111/j.1365-294X.2009.04211.x, lire en ligne, consulté le )
- F. M. Climo, « The Powelliphanta gilliesi — traversi — hochstetteri — rossiana — lignaria — superba ring species (Mollusca: Pulmonata) », New Zealand Journal of Zoology, vol. 5, no 2, , p. 289–294 (ISSN 0301-4223, DOI 10.1080/03014223.1978.10428318, lire en ligne, consulté le )
- Michael A. Patten et Christin L. Pruett, « The Song Sparrow, Melospiza melodia, as a ring species: Patterns of geographic variation, a revision of subspecies, and implications for speciation », Systematics and Biodiversity, vol. 7, no 1, , p. 33–62 (ISSN 1477-2000, DOI 10.1017/S1477200008002867, lire en ligne, consulté le )
Articles connexes modifier
Liens externes modifier
- (en) Pouillot verdâtre
- (en) Chants et cartes de répartition du pouillot verdâtre
- (en) Salamandre du genre Ensatina
- (en) Espèces annulaire — version abrégée, par Peter Hadfield
- (en) Musée d'Histoire Naturelle de Nouvelle-Écosse : Oiseaux de Nouvelle-Écosse
- (en) Croisements entre goélands hybrides de Belgique