Tris(pentafluorophényl)borane
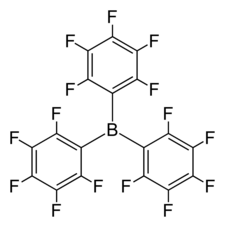
Le tris(pentafluorophényl)borane, parfois abrégé BCF, est un composé chimique de formule (C6F5)3B. Il se présente sous la forme d'un solide blanc volatil et hygroscopique, formant un trihydrate [(C6F5)3BOH2](H2O)2, dans lequel l'une des molécules d'eau est coordonnée au bore tandis que les deux autres forment de liaisons hydrogène avec la première. La molécule est constituée de trois groupes pentafluorophényle –C6F5 liés à un atome de bore central. Le motif BC3 central est plan. Il est parfois présenté comme « l'acide de Lewis idéal » car il est polyvalent et ses liaisons B–C sont relativement inertes par rapport aux composés fluorés du bore apparentés, comme ceux qui contiennent des groupes B–CF3, qui se décomposent en formant des liaisons B–F.
| Tris(pentafluorophényl)borane | |
| |
| Structure du tris(pentafluorophényl)borane | |
| Identification | |
|---|---|
| Nom UICPA | tris(2,3,4,5,6-pentafluorophényl)borane |
| No CAS | |
| No ECHA | 100.116.286 |
| No CE | 601-014-5 |
| PubChem | 582056 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C18BF15 |
| Masse molaire[1] | 511,98 ± 0,021 g/mol C 42,23 %, B 2,11 %, F 55,66 %, |
| Propriétés physiques | |
| T° fusion | 126 à 131 °C[2] |
| Précautions | |
| SGH[3] | |
| H301, H315, H319, H335, H410, P261, P280, P301+P310, P305+P351+P338, P405 et P501 |
|
| Transport[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
On l'obtient à l'aide de réactifs de Grignard à partir du bromopentafluorobenzène C6F5Br :
- 3 C6F5MgBr + BCl3 → (C6F5)3B + 3 MgBrCl
La synthèse initiale employait du C6F5Li, mais ce réactif est susceptible de détoner avec élimination de fluorure de lithium[4] LiF.
Acidité de Lewis et applications modifier
La propriété la plus remarquable de cette molécule est sa forte acidité de Lewis. Sa force de son acidité, déterminée par la méthode de Gutmann-Beckett (en) et la méthode de Childs[5], est comparable à celle du trifluorure de bore BF3 mais est inférieure à celle du trichlorure de bore BCl3. Cela indique que l'électronégativité des groupes pentafluorobenzène –C6F5 est semblable à celle des halogénures.
L'une des applications du (C6F5)3B est la formation d'anions non coordinants en retirant des ligands anioniques de complexes métalliques[6]. Le tris(pentafluorophényl)borane peut ainsi être utilisé comme activateur ou cocatalyseur dans la réaction de polymérisation des alcènes :
- (C6F5)3B + (C5H5)2Zr(CH3)2 → [(C5H5)2ZrCH3]+[(C6F5)3BCH3]−.
Au cours de ce processus, le groupe méthyle –CH3 fortement coordinant est transféré sur l'atome de bore en exposant un site réactif au zirconium. Le zirconocène cationique résultant est stabilisé par l'anion non coordinant dérivé du tris(pentafluorophényl)borane. Le site exposé sur le zirconium permet la coordination d'alcènes, nécessaire à la polymérisation de ces derniers.
Le tris(pentafluorophényl)borane a également permis de développer des catalyseurs/activateurs « immobilisés » sur un support inorganique inerte tel que la silice[7].
Ce composé est par ailleurs capable de capturer un ion hydrure pour former l'anion [(C6F5)3BH]− et de catalyser l'hydrosilylation des aldéhydes. Il se lie en outre à une grande variété de bases de Lewis, même à celles qui sont faiblement basiques[8].
Les halogénures de pentafluorophénylborane sont des composés apparentés[9].
Paire de Lewis frustrée et autres réactions modifier
Le tris(pentafluorophényl)borane est un réactif important conduisant au concept de paire de Lewis frustrée (en). La combinaison de cette molécule et de phosphines basiques, comme la tricyclohexylphosphine PCy3 clive l'hydrogène[10] H2 :
- (C6F5)3B + PCy3 + H2 → (C6F5)3BH− + HPCy3+.
De nombreux phosphines, boranes et substrats apparentés participent à des réactions semblables.
On utilise le (C6F5)3B pour préparer un composé contenant une liaison Xe–C :
- (C6F5)3B + XeF2 → [C6F5Xe]+[(C6F5)2BF2]−.
Il forme du tétrakis(pentafluorophényl)borate de lithium LiBArF4, un sel de l'anion non coordinant [BArF4]−, en réagissant avec le pentafluorophényllithium C6F5Li :
- (C6F5)3B + C6F5Li → Li[(C6F5)4B].
Notes et références modifier
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Tris(pentafluorophenyl)borane 95%, consultée le 12 octobre 2018.
- « Fiche du composé Tris(pentafluorophenyl)borane, 97% », sur Alfa Aesar (consulté le ).
- (en) Warren E. Piers et Tristram Chivers, « Pentafluorophenylboranes: from obscurity to applications », Chemical Society Reviews, vol. 26, no 5, , p. 345-354 (DOI 10.1039/CS9972600345, lire en ligne)
- (en) Ronald F. Childs, D. Lindsay Mulholland et Alan Nixon, « The Lewis acid complexes of α,β-unsaturated carbonyl and nitrile compounds. A nuclear magnetic resonance study », Revue canadienne de chimie, vol. 60, no 6, , p. 801-808 (DOI 10.1139/v82-117, lire en ligne)
- (en) Hans Fuhrmann, Simon Brenner, Perdita Arndt et Rhett Kempe, « Octahedral Group 4 Metal Complexes That Contain Amine, Amido, and Aminopyridinato Ligands: Synthesis, Structure, and Application in α-Olefin Oligo- and Polymerization », Inorganic Chemistry, vol. 35, no 23, , p. 6742-6745 (PMID 11666837, DOI 10.1021/ic960182r, lire en ligne)
- (en) John R. Severn, John C. Chadwick, Robbert Duchateau et Nic Friederichs, « “Bound but Not Gagged” — Immobilizing Single-Site α-Olefin Polymerization Catalysts », Chemical Reviews, vol. 105, no 11, , p. 4073-4147 (PMID 16277372, DOI 10.1021/cr040670d, lire en ligne)
- (en) Gerhard Erker, « Tris(pentafluorophenyl)borane: a special boron Lewis acid for special reactions », Dalton Transactions, no 11, , p. 1883-1890 (DOI 10.1039/B503688G, lire en ligne)
- (en) Tristram Chivers, « Pentafluorophenylboron halides: 40 years later », Journal of Fluorine Chemistry, vol. 115, no 1, , p. 1-8 (DOI 10.1016/S0022-1139(02)00011-8, lire en ligne)
- (en) Douglas W. Stephan, « Frustrated Lewis pairs: a new strategy to small molecule activation and hydrogenation catalysis », Dalton Transactions, no 17, , p. 3129-3136 (DOI 10.1039/B819621D, lire en ligne)


