Trinitrométhane
Le trinitrométhane, ou nitroforme, est un composé chimique de formule HC(NO2)3. Il s'agit d'un oxydant qui peut être produit industriellement par réaction de l'acétylène HC≡CH avec l'acide nitrique HNO3 anhydre, ou au laboratoire par hydrolyse ménagée du tétranitrométhane C(NO2)4. La molécule HC(NO2)3 est incolore tandis que l'anion (NO2)3C− est jaune vif.
| Trinitrométhane | |
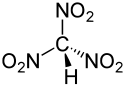 Structure du trinitrométhane |
|
| Identification | |
|---|---|
| Nom UICPA | trinitrométhane |
| Synonymes |
nitroforme |
| No CAS | |
| No ECHA | 100.007.489 |
| No CE | 208-236-8 |
| PubChem | 10602 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | CHN3O6 [Isomères] |
| Masse molaire[2] | 151,035 1 ± 0,003 3 g/mol C 7,95 %, H 0,67 %, N 27,82 %, O 63,56 %, |
| pKa | 0,17 à 20 °C[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le trinitrométhane est très soluble dans l'eau, donnant une solution stable de couleur jaune en raison de l'anion (NO2)3C−. Le pKa de ce composé vaut 0,17 ± 0,02 à 20 °C, ce qui est remarquablement acide pour un dérivé du méthane[1]. Certains indices suggèrent que l'anion (NO2)3C−, qui obéit à la règle de Hückel, soit aromatique
HC(NO2)3 forme un ensemble de sels ioniques jaunes dont un grand nombre sont instables et peuvent facilement détoner sous l'effet d'un choc ou de la chaleur. Ceci rend dangereuse la manipulation des solutions aqueuses de trinitrométhane, qui sont acides, en raison de la corrosion des surfaces en fer ou en aluminium, de façon semblable à celle de l'acide picrique.
Notes et références modifier
- (en) S. S. Novikov, V. I. Slovetskii, S. A. Shevelev et A. A. Fainzil'berg, « Spectrophotometric determination of the dissociation constants of aliphatic nitro compounds », Bulletin of the Academy of Sciences of the USSR, Division of chemical science, vol. 11, no 4, , p. 552-559 (lire en ligne) DOI 10.1007/BF00904751
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.