Trichlorure de tétraéthylammonium
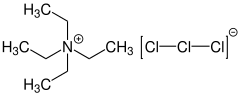
Le trichlorure de tétraéthylammonium (également connu sous le nom de réactif de Mioskowski)[3] est un composé chimique de formule [NEt4][Cl3] constitué d'un cation tétraéthylammonium et d'un trichlorure comme anion. Le trichlorure est l'un des anions polychlorés les plus simples[4]. Le trichlorure de tétraéthylammonium est utilisé comme réactif pour les réactions de chloration et d'oxydation.
| Trichlorure de tétraéthylammonium | |
| |
| Identification | |
|---|---|
| Nom UICPA | trichlorure de tétraéthylammonium |
| Synonymes |
réactif de Mioskowski |
| No CAS | |
| PubChem | 134992260 |
| SMILES | |
| Apparence | solide jaune |
| Propriétés chimiques | |
| Formule | C8H20Cl3N |
| Masse molaire[1] | 236,61 ± 0,014 g/mol C 40,61 %, H 8,52 %, Cl 44,95 %, N 5,92 %, |
| Propriétés physiques | |
| Solubilité | soluble dans le dichlorométhane, l'éthanol, l'acétonitrile et la pyridine[2] |
| Écotoxicologie | |
| LogP | 3,95 |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Propriétés modifier
À température ambiante, le trichlorure de tétraéthylammonium est un solide jaune soluble dans les solvants organiques polaires (par exemple, le dichlorométhane ou l'acétonitrile ). Comme il s'agit d'un oxydant puissant et d'un agent de chloration, il réagit avec la plupart des solvants organiques[2].
Préparation modifier
Généralement, le trichlorure de tétraéthylammonium est préparé par réaction de chlorure de tétraéthylammonium et de chlore élémentaire dans le dichlorométhane à température ambiante . Après l'évaporation du solvant, le trichlorure de tétraéthylammonium est obtenu sous forme d'un solide jaune.
[NEt4]Cl + Cl2 → [NEt4][Cl3]
Récemment, une préparation alternative de trichlorure de tétraéthylammonium a été décrite en utilisant du chlorure de tétraéthylammonium et du peroxymonosulfate de potassium comme oxydant[3].
Applications modifier
En général, le trichlorure de tétraéthylammonium a une réactivité similaire à celle du chlore élémentaire et d'autres trichlorures, comme le trichlorure de triéthylméthylammonium. Puisque le trichlorure de tétraéthylammonium est un solide et peut être dissous dans le dichlorométhane ou de l'acétonitrile, il est utilisé comme un réactif alternatif plus facile à manipuler au chlore élémentaire, en particulier pour la synthèse d'intermédiaires dans la synthèse de produits naturels[5],[6],[7].
Le trichlorure de tétraéthylammonium réagit avec les alcènes pour générer les alcanes 1,2-dichlorés correspondants et, de manière similaire, avec les alcynes pour générer les alcènes dichlorés trans correspondants. Les cycles aromatiques riches en électrons sont chlorés en position para. Alors que les aldéhydes sont dichlorés en position alpha, les cétones ne subissent qu'une réaction de chloration, générant ainsi les cétones monochlorées en alpha.
En présence de 1,4-diazabicyclo[2.2.2]octane, le trichlorure de tétraéthylammonium est un oxydant et il est utilisé pour l'oxydation des alcools primaires en aldéhydes et des alcools secondaires en cétones. Pour les composés portant à la fois un alcool primaire et un alcool secondaire, on observe une oxydation sélective de l'alcool secondaire. Les acétals subissent une chloration CH de la liaison CH tertiaire fournissant les acétals chlorés correspondants[2].
Références modifier
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Thierry Schlama, Kiroubagaranne Gabriel, Véronique Gouverneur et Charles Mioskowski, « Tetraethylammonium Trichloride: A Versatile Reagent for Chlorinations and Oxidations », Angewandte Chemie International Edition in English, vol. 36, no 21, , p. 2342–2344 (ISSN 0570-0833 et 1521-3773, DOI 10.1002/anie.199723421, lire en ligne, consulté le )
- Jingyun Ren et Rongbiao Tong, « Convenient in situ generation of various dichlorinating agents from oxone and chloride: diastereoselective dichlorination of allylic and homoallylic alcohol derivatives », Organic & Biomolecular Chemistry, vol. 11, no 26, , p. 4312–5 (PMID 23715511, DOI 10.1039/c3ob40670a)
- (en) Karsten Sonnenberg, Lisa Mann, Frenio A. Redeker et Benjamin Schmidt, « Polyhalogen and Polyinterhalogen Anions from Fluorine to Iodine », Angewandte Chemie International Edition, vol. 59, no 14, , p. 5464–5493 (ISSN 1433-7851 et 1521-3773, DOI 10.1002/anie.201903197, lire en ligne, consulté le )
- (en) Christian Nilewski, Nicholas R. Deprez, Thomas C. Fessard et Dong Bo Li, « Synthesis of Undecachlorosulfolipid A: Re-evaluation of the Nominal Structure », Angewandte Chemie International Edition, vol. 50, no 34, , p. 7940–7943 (DOI 10.1002/anie.201102521, lire en ligne, consulté le )
- (en) Nikolas Huwyler et Erick M. Carreira, « Total Synthesis and Stereochemical Revision of the Chlorinated Sesquiterpene (±)-Gomerone C », Angewandte Chemie International Edition, vol. 51, no 52, , p. 13066–13069 (DOI 10.1002/anie.201207203, lire en ligne, consulté le )
- (en) Wei Ju, Xudong Wang, Hailong Tian et Jinghan Gui, « Asymmetric Total Synthesis of Clionastatins A and B », Journal of the American Chemical Society, vol. 143, no 33, , p. 13016–13021 (ISSN 0002-7863 et 1520-5126, DOI 10.1021/jacs.1c07511, lire en ligne, consulté le )
