Stéarate de zinc
| Stéarate de zinc | |
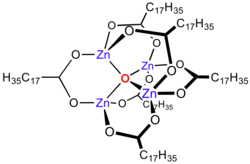
| |
| Structure du Stéarate de zinc. | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.008.321 |
| No CE | 209-151-9 |
| PubChem | 11178 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche |
| Propriétés chimiques | |
| Formule | C36H70O4Zn |
| Masse molaire[1] | 632,32 ± 0,05 g/mol C 68,38 %, H 11,16 %, O 10,12 %, Zn 10,34 %, |
| Propriétés physiques | |
| T° fusion | 120 à 130 °C |
| Solubilité | dans l'eau : nulle |
| Masse volumique | 1,095 g·cm-3 |
| Précautions | |
| SGH | |
| H335, H400, H413, P261, P271, P273, P312, P391, P304+P340, P405, P403+P233 et P501 |
|
| NFPA 704 | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le stéarate de zinc (C36H70O4Zn) est un « savon au zinc » largement utilisé dans l'industrie, au sens de « sel » métallique d'un acide gras. C'est un solide blanc qui repousse l'eau. Il est insoluble dans les solvants polaires comme l'alcool ou l'éther mais se dissout bien à chaud dans les solvants aromatiques comme le benzène. Parmi les savons métalliques, il est le plus puissant agent de démoulage (en). Il ne contient pas d'électrolyte et a un effet hydrophobe. Il est principalement utilisé dans l'industrie des plastiques et du caoutchouc, en tant qu'agent de démoulage et lubrifiant facilement incorporé[2].
Les carboxylates de zinc, comme l'acétate de zinc, adoptent des formules complexes, et ne sont pas seulement des dicarboxylates de zinc. En effet, la formule de la plupart se met sous la forme Zn4O(O2CR)6, avec un noyau de Zn4O6+ entouré de ligands carboxylates.
Usages modifier
Il est largement utilisé comme agent de démoulage pour la production d'objets divers, en caoutchouc, polyuréthane, polyester, mais aussi dans la métallurgie. Ces applications exploitent ses propriétés d'anti-adhésif[2]. Pour les cosmétiques, le stéarate de zinc est un lubrifiant et un épaississant[3].
Il est aussi utilisé par des magiciens pour réduire le frottement entre les cartes à jouer.
Article connexe modifier
Notes et références modifier
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Zinc stearate » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- David J. Anneken, Sabine Both, Ralf Christoph, Georg Fieg, Udo Steinberner, Alfred Westfechtel, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, , « Fatty Acids ». DOI 10.1002/14356007.a10_245.pub2
- (en) « Le stéarate de zinc », sur cosmeticsinfo.org


