Radiothérapie à l'iode 131
La radiothérapie à l'iode 131 est un procédé thérapeutique utilisant la médecine nucléaire destiné à traiter la maladie de Basedow, le nodule toxique, le goitre et certaines formes de cancer de la thyroïde. On utilise l'isotope 131 de l'iode, iode 131, noté 131I, qui se désintègre de façon prédominante par radioactivité β, avec une période de 8 jours, et qui n'est emmagasinée dans le corps humain que dans les cellules de la thyroïde.
La radiothérapie à l'iode 131 est soumise dans bien des pays à des conditions légales spécifiques, par exemple en Allemagne, elle ne peut être effectuée que par hospitalisation. On utilise cette forme de thérapeutique depuis les années 1940, elle est considérée comme ayant peu d'effets secondaires, et comme sûre après de longues années d'observation. En Allemagne, il existe en 2014 environ 120 installations thérapeutiques où l'on pratique annuellement environ 50 000 traitements[1].
Domaines d'application et alternatives modifier
Les indications les plus courantes de la radiothérapie à l'iode 131 sont les nodules toxiques, le goitre multinodulaire, la maladie de Basedow et les formes de cancer de la thyroïde qui stockent l'iode : cancers papillaires et vésiculaires. Le goitre sans perturbation fonctionnelle est aussi de plus en plus traité par la radiothérapie à l'iode 131[2].
La grossesse est considérée comme une contre-indication absolue à la radiothérapie par l'iode 131 pour les maladies bénignes de la thyroïde. À partir de toutes les estimations biologiques, on recommande d'éviter la grossesse dans les 6 mois suivant un traitement par radiothérapie à l'iode. Si malgré tout il survient une grossesse pendant cette période, on ne considère pas que ce soit une raison suffisante pour un avortement. Il est cependant recommandé de prendre en considération un conseil génétique. Avec une radiothérapie à l'iode pour un cancer de la thyroïde, on peut certes calculer la probabilité théorique d'un dommage génétique, cependant de tels dommages n'ont pas été observés jusqu'à présent[2].
D'autres méthodes curatives pour les perturbations fonctionnelles sont diverses formes d'opérations de la thyroïde, et pour les nodules toxiques dans certains cas leur élimination par injection d'alcool[3]. La maladie de Basedow peut dans certains cas être provisoirement ou durablement être contenue dans ses effets par un traitement médicamenteux avec des antithyroïdiens (rémission), mais pour une guérision définitive, il faut considérer soit la radiothérapie à l'iode, soit la chirurgie. Pour les cancers de la thyroïde, ce n'est que pour le cancer papillaire en stade précoce pT1a que l'on peut renoncer après l'opération à la radiothérapie à l'iode. Pour le traitement des hypertrophies bénignes, on peut utiliser la prescription de médicaments antithyroïdiens, l'ablation chirurgicale ou la radiothérapie à l'iode.
Pour le choix entre l'opération et la radiothérapie à l'iode, on peut citer les arguments suivants en faveur de la radiothérapie : la thyroïde a déjà été opérée, ou il y a déjà une paralysie (unilatérale) du nerf laryngé récurrent, le patient est âgé ou atteint de lourdes maladies associées, la thyroïde est relativement petite, ou le patient souffre de crainte de l'opération. Un jeune âge n'est plus considéré comme une contre-indication. Pour l'opération, on peut citer les arguments suivants : soupçons de malignité, hyperthyroïdie due à un excès d'iode, grossesse et allaitement, exophtalmie - dans la maladie de Basedow, signes de compression des structures avoisinantes (trachée : stridor, œsophage : dysphagie, vaisseaux du cou : syndrome de la veine cave supérieure, crainte des rayonnements, ou régions étendues de la thyroïde ne fixant pas l'iode[2],[4].
Médecine vétérinaire modifier
En médecine vétérinaire, la radiothérapie à l'iode 131 est utilisée comme premier choix pour l'hyperthyroïdie féline, mais ne peut être utilisée que dans une mesure limitée, en raison des conditions techniques préalables et des exigences de radioprotection[5].
Conditions légales modifier
Dans la plupart des pays, l'utilisation de la radiothérapie à l'iode est soumise à des contraintes légales et réglementaires. Dans beaucoup de pays elle peut être pratiquée en ambulatoire.
En France, elle est soumise au cadre général des règles de la radioprotection.
En Allemagne, la réglementation de protection nucléaire et les directives édictées par le comité de Land pour l'énergie nucléaire encadrent l'application de la radiothérapie par l'iode. Elles posent le principe que cette radiothérapie ne peut être pratiquée que sous hospitalisation spécialisée. Le médecin responsable doit avoir une autorisation de pratique, attribuée en lien avec un « certificat de compétence dans le domaine de l'utilisation de matières radioactives pour le diagnostic et la thérapeutique. » La présence d'un expert en physique médicale est nécessaire. Les aspects architecturaux et personnels doivent être considérés en liaison avec les exigences de la protection contre le rayonnement. En particulier, il doit y avoir une installation de refroidissement (décroissance) des effluents appropriée pour les effluents radioactifs. Le personnel doit être régulièrement instruit en protection contre les rayonnements.
En Autriche, le traitement en ambulatoire est possible. La loi limite les activités maximales de radioactivité, et la collaboration d'un physicien de la médecine est nécessaire.
En Suisse, les radiothérapies à l'iode peuvent être effectuées en ambulatoire jusqu'à une activité de 200 MBq.
Aux États-Unis, les radiothérapies à l'iode peuvent être pratiquées en ambulatoire jusqu'à 1 110 MBq. Ceci permet de réaliser en ambulatoire la plupart des radiothérapies pour des maladies bénignes de la thyroïde.
Principe de la thérapeutique et bases physiques modifier
L'iode 131 utilisé est disponible sous forme d'iodure de sodium en gélule ou en solution aqueuse. Il est administré normalement par voie orale, mais peut être dans certains cas (par exemple en cas de difficultés de déglutition) injecté par voie intraveineuse. Par voie orale, l'iodure de sodium est rapidement absorbé par la muqueuse stomacale et passe dans le sang. L'iode pénètre rapidement par symport Na/I dans les cellules de la thyroïde et est finalement stocké dans les follicules de la thyroïde. Sous l'action de la TSH ou des anticorps anti-récepteurs à la thyréostimuline (« TRAK »), ou anti-thyropéroxydase (« anti-TPO »), l'absorption de l'iode dans les cellules thyroïdiennes augmente. Des parties autonomes de la thyroïde peuvent absorber l'iode indépendamment de la TSH.
L'élégance particulière de la radiothérapie à l'iode réside dans le fait que seules les cellules thyroïdiennes peuvent absorber l'iode, et donc l'iode radioactif, les autres organes n'en stockant pas. L'iode non stocké dans la thyroïde est éliminé en peu de temps par les reins et de là dans l'urine. De faibles quantités sont aussi éliminées par les glandes sudoripares et la muqueuse de l'intestin. Il est aussi éliminé en partie par les glandes salivaires et la muqueuse stomacale, mais cette fraction est réabsorbée par l'intestin. En raison de ces propriétés particulières de la circulation de l'iode dans le corps, on peut obtenir une dose de rayonnement très élevée dans le tissu-cible, tandis que le reste du corps ne souffre que d'une faible exposition.
131I est un nucléide obtenu dans des réacteurs nucléaires et possède une période de 8,02 jours. Au cours de sa désintégration en xénon stable, il libère une particule β d'énergie maximale de 0,61 MeV et un parcours moyen dans le tissu de 0,5 mm. C'est ce rayonnement qui est responsable de l'activité thérapeutique. En outre, un rayon gamma d'énergie maximale de 364 keV est aussi émis. Il peut sortir de la thyroïde, et être responsable d'une irradiation indésirable du patient et de son environnement, mais il peut être utilisé pour le contrôle de la fixation de l'iode radioactif.
Les rayons β font des dommages dans l'ADN au voisinage immédiat de la thyroïde, en particulier des ruptures du double brin, qui finissent par la mort programmée de la cellule (apoptose).
Radiothérapie à l'iode pour les maladies bénignes de la thyroïde modifier
Préparation modifier
Carence en iode modifier
Pour obtenir une absorption optimale de l'iode dans la thyroïde, il faut éviter des apports supplémentaires d'iode avant le test au radioiode et la radiothérapie à l'iode (temps de carence à l'iode). Ces apports supplémentaires d'iode sont en particulier les produits de contraste iodés, l'antiarythmique amiodarone et certains produits désinfectants contenant de l'iode. Pour des produits de contraste en solution aqueuse, un temps de carence de 6 semaines est suffisant. Après l'utilisation de produits de contraste en solution huileuse, ou de l'amiodarone, qui est liposoluble, la thyroïde peut être bloquée pour plusieurs mois.
L'iode en quantité non négligeable est contenu dans de nombreuses préparations vitaminiques et compléments alimentaires, ainsi que dans le poisson de mer, les fruits de mer et certains produits à base d'algues. Ces sources d'iode doivent être évitées pendant environ une semaine avant le test à l'iode et la radiothérapie. L'absorption d'iode en provenance de sel de table iodé, ou de plats confectionnés avec ce dernier, même en préparation industrielle, n'est pratiquement pas à éviter.
Réglage du métabolisme modifier
La radiothérapie à l'iode ne devrait pas être mise en œuvre en cas d'hyperthyroïdie manifeste, parce que la fonction exagérée peut être renforcée par la libération des hormones thyroïdiennes thyroxine (T4) et triiodothyronine (T3). C'est pourquoi il faut atteindre pendant les semaines précédant la radiothérapie des valeurs normales pour T4 et T3 avec des doses minimales d'antithyroïdiens. Cependant les antithyroïdiens diminuent l'absorption de l'iode par la thyroïde, si bien qu'il est recommandé d'interrompre leur administration au moins un ou deux jours avant la radiothérapie.
En cas de nodule toxique, la concentration de la TSH doit être diminuée autant que possible, pour minimiser l'absorption d'iode par la boucle d'asservissement dans les parties hors nodule toxique. À l'occasion, il faut pour cela administrer des hormones thyroïdiennes pendant la phase de préparation. Pour un goitre fonctionnellement normal, la radiothérapie est normalement effectuée sans autres médicaments agissant sur la thyroïde.
Évaluation de l'activité thérapeutique appropriée modifier
La directive allemande sur la protection contre le rayonnement en médecine, par exemple, prévoit que « Pour la planification d'un traitement en médecine nucléaire, il faut prévoir à l'avance la dose pour les organes ou tissus à traiter [ … ] et ensuite déterminer l'activité à administrer. Dans la mesure où des paramètres spécifiques au patient sont nécessaires, il faut faire les mesures individuelles dans ce but et en extraire les données[6]. »
Pour déterminer l'activité nécessaire pour la radiothérapie, il faut faire appel, en Allemagne et en Autriche, à côté du médecin spécialisé en médecine nucléaire, à un physicien médical. Pour le calcul, il faut faire entrer en compte la dose visée, le volume visé et l'intégrale dans le temps de l'activité dans la thyroïde.
Le volume cible de la radiothérapie et la dose d'énergie visée pour ce volume cible se déterminent d'après la maladie à traiter. Pour la maladie de Basedow, pour une dilatation de la thyroïde sans toxicité ou pour une toxicité disséminée, l'ensemble du volume de la thyroïde, déterminé par échographie, est considéré comme volume cible, tandis que pour un nodule toxique unifocal ou multifocal, seul est pris en compte le volume nodulaire. À titre d'exemple, les doses visées selon les directives de la société allemande de médecine nucléaire pour la radiothérapie à l'iode de maladies bénignes de la thyroïde sont données par la table suivante :
| Dose visée pour la radiothérapie | Demi-vie effective | ||
|---|---|---|---|
| Maladie | Dose visée | Thyroïde normale | Hyperthyroïdie |
| Nodule toxique | ~ 300 à 400 Gy | 4,8 j. | 4,2 j. |
| Toxicité multifocale | ~ 150 Gy | 5,5 j. | 4,8 j. |
| Toxicité disséminée | ~ 150 Gy | 5,5 j. | 4,8 j. |
| Maladie de Basedow | — | — | 4,2 j. |
| Concept ablatif | ~ 200 à 300 Gy | — | — |
| Optimisation fonctionnelle | ~ 150 Gy | — | — |
| Diminution de goitre | ~ 120 à 150 Gy | 5,5 j. | — |
L'intégrale de l'activité dans le temps peut être déterminée par un test au radioiode[7]. Pour cela, on administre une faible quantité d'iode radioactif (usuellement par voie orale) : de 1 à 5 MBq de 131I, ou plus rarement, de 5 à 10 MBq de 131I[2]. À des instants bien définis, on mesure l'activité au niveau de la thyroïde et on la compare à l'activité totale et à sa décroissance naturelle. On en détermine la dose maximale admissible et la demi-vie effective en jours. Plus on obtient de points de mesure, mieux on connaît la surface sous la courbe de décroissance. Pour des raisons pratiques d'applicabilité en ambulatoire, on se limite en général à des mesures après 24 et 48 h, parfois seulement après 24 h. Pour la maladie de Basedow, en raison du métabolisme accéléré de l'iode, il faut faire une première mesure après 4 à 8 h. Pour une détermination précise de la demi-vie effective, il faut faire une mesure supplémentaire après 4 à 8 j. Mais en raison des faibles différences entre divers patients pour la même maladie et la même situation métabolique, la demi-vie effective peut être estimée empiriquement (cf. table).
L'activité thérapeutique à utiliser peut être calculée d'après la formule de Marinelli (d'après Leonidas D. Marinelli, 1906–1974, Argonne National Laboratory)[8],[9].
Ici, A est l'activité visée, DO la dose délivrée à l'organe, V le volume cible, K une constante déterminée empiriquement de 24,7, Umax l’uptake (absorption) maximal et t0,5 eff la demi-vie effective.
Prétraitement à la cortisone dans le cas de l'orbitopathie endocrine modifier
Une orbitopathie endocrine dans le cas de la maladie de Basedow peut se détériorer sous l'action de la radiothérapie à l'iode, voire apparaître à cette occasion. Si elle existe déjà, on recommande à partir du jour de la radiothérapie, ou de la veille, un traitement aux glucocorticoïdes (cortisone), en réglant le dosage selon la gravité de la maladie de l'œil. Pour la maladie de Basedow sans orbitopathie endocrine, l'administration préventive de glucocorticoïdes est controversée. Les effets secondaires et les contre-indications de la thérapeutique à la cortisone (diabète sucré, ulcère gastro-duodénal, déséquilibre hydro-électrolytique) doivent être surveillés[2].
Explications modifier
Avant le début du test à l'iode radioactif, et de la radiothérapie à l'iode, le patient doit recevoir des explications médicales. Il doit être informé du déroulement du test et de la thérapeutique, ainsi que des risques et des effets secondaires de la radiothérapie. Dans les pays où la radiothérapie ne peut être pratiquée en ambulatoire, il doit être particulièrement souligné que le patient, après avoir reçu l'activité thérapeutique, ne doit pas quitter l'établissement de soins. En outre, le patient est informé que des contrôles réguliers sont médicalement nécessaires et légalement prescrits (voir Suivi).
Exécution modifier
Après l'administration du 131I, généralement par voie orale, exceptionnellement par voie intraveineuse, en Allemagne, le patient doit rester au minimum 48 h dans l'établissement de soins. On recommande de rester à jeun environ une heure après la prise d'iode par voie orale, pour laisser à l'iode le temps d'être largement absorbé[2].
D'habitude, s'ensuivent des mesures régulières du rayonnement qui permettent de conclure à l'activité radioactive restant dans le corps entier et dans la thyroïde du patient. La première est importante pour déterminer le moment où le patient peut être autorisé à sortir de l'établissement de soins, la seconde pour contrôler l'activité à la glande, maximale et au cours du temps. On peut ainsi déterminer la dose maximale (Umax) et la demi-vie effective atteinte (t0,5 eff), et ainsi déterminer via la formule de Marinelli la dose DO délivrée à l'organe. Le volume visé V et la constante empirique K ne changent pas.
Si la dose à l'organe est substantiellement plus élevée que prévu, on doit très probablement s'attendre au développement d'une hypothyroïdie après la thérapie et prévoir des soins correspondants.
Si par contre la dose à l'organe est substantiellement inférieure, on peut, pendant le séjour en centre de soins, donner une dose supplémentaire d'iode radioactif, pour atteindre la dose visée et assurer le succès de la thérapie. Il faut alors considérer qu'en raison de l'action rapide de la radiothérapie, (stunning - engourdissement), l'assimilation de la deuxième dose est régulièrement plus basse que celle de la première.
L'administration de faibles quantités d'iode non-radioactif ou de lithium après celle du radioiode permet d'allonger le temps de séjour du radioiode dans la thyroïde, et par là d'allonger le temps de demi-vie effective t0,5 eff, et d'obtenir ainsi une augmentation de dose à l'organe jusqu'à 30 %. Il faut alors, en particulier pour le lithium, envisager les risques et effets secondaires, ainsi que le faible index thérapeutique[2].
Risques et effets secondaires modifier
Exposition aux rayonnements modifier
En raison des propriétés biologiques de l'iode et des propriétés physiques du 131I, la radiothérapie à l'iode ne cause qu'une faible exposition au rayonnement des organes qui n'absorbent pas l'iode. L'exposition au rayonnement est faible dans les structures voisines de la thyroïde, comme le larynx ou les parathyroïdes - en raison du faible parcours moyen du rayonnement β émis par la thyroïde. Certains tissus qui expriment le symport Na/I, comme les glandes salivaires, l'estomac ou les seins s'enrichissent temporairement en iode. Les reins, la vessie et l'intestin participent à l'élimination de la fraction de l'iode radioactif qui n'est pas stockée dans la thyroïde. Dans tous ces organes existe une faible intégrale sur le temps de l'activité, et l'exposition au rayonnement est donc faible. Pour une assimilation de 25 % dans la thyroïde de 350 mGy/MBq, elle se situe dans la paroi stomacale à 0,46 mGy/MBq, pour les ovaires à 0,04 mGy/MBq, pour la moelle osseuse rouge à 0,07 mGy/MBq, pour le foie à 0,035 mGy/MBq et pour les testicules à 0,028 mGy/MBq[10]. Le rapport entre les effets souhaités sur la thyroïde et indésirables sur les autres organes est donc de quelques puissances de 10.
Les études de cohorte de Hall en 1992 avec plus de 45 000 patients[11] et de Ron en 1998 avec plus de 35 000 patients[12] n'ont pas établi de surmortalité par cancer chez les patients traités à l'iode radioactif. L’American Thyroid Association (Association américaine sur la thyroïde) indique la possibilité d'une augmentation minimale de l'incidence de carcinomes de la thyroïde après un traitement[13].
Effets secondaires aigus modifier
Il n'y a que peu de cas d'effets secondaires aigus, et ceux-ci sont pour la plupart sans danger. Le plus fréquent est la thyroïdite, réaction inflammatoire douloureuse de la thyroïde provoquée par l'effet aigu du rayonnement, et qui peut survenir entre 3 et 5 jours après la prise de l'iode radioactif. Les douleurs sont d'habitude bien calmées par le rafraîchissement et les médicaments anti-inflammatoires comme des anti-inflammatoirea non stéroïdiena ou des glucocorticoïdes. Un gonflement accompagnant l'inflammation de la thyroïde ne peut conduire à des problèmes sérieux comme la suffocation qu'en cas de rétrécissement préalable de la trachée, si bien que dans ces cas, on recommande un traitement anti-inflammatoire préventif[2].
Les gonflements par inflammation des glandes salivaires ne surviennent d'habitude que pour de hautes activités thérapeutiques.
Dans le cas d'hyperthyroïdie avant le traitement, celle-ci peut s'aggraver environ 7 à 10 j. après le début du traitement, en raison du début de la mort cellulaire et de la libération concomitante d'hormones qui étaient stockées dans la thyroïde. Cette complication peut être évitée par un bon établissement d'un métabolisme normal avant le traitement.
Un effet secondaire rare après une radiothérapie en raison d'un nodule toxique est l'apparition d'une hyperthyroïdie immunogène (maladie de Basedow) quelques semaines plus tard. Ce phénomène est nommé syndrome de Marine-Lenhart, et s'éteint généralement spontanément. L'incidence est donnée par 0,5 à 1 %[2]. Dans une partie des cas, en raison de la nouvelle survenance d'une hyperthyroïdie, il faut faire une deuxième radiothérapie.
Sortie après la thérapie modifier
En Allemagne, le minimum de séjour en hôpital pour la thérapie est de 48 h. Le moment précis de la sortie dépend de l'activité résiduelle dans le corps. En 1999, la valeur limite pour cette activité résiduelle a été augmentée : le débit de dose à 2 m du patient ne doit pas dépasser 3,5 µSv/h, ce qui fait qu'en un an l'exposition totale à 2 m ne dépassera pas 1 mSv. Ceci correspond à une activité résiduelle d'environ 250 MBq. Des règles comparables sont valables pour d'autres pays.
En Suisse, l'exposition pour des « tierces personnes » ne doit pas dépasser 1 mSv/an, et pour la parentèle du patient 5 mSv/an (« personnes non soignantes professionnellement »)[14]. Pour la sortie après la radiothérapie à l'iode, le débit de dose à 1 m ne doit pas dépasser 5 µSv/h, ce qui correspond à une activité résiduelle d'environ 150 MBq[15].
En Allemagne, la durée moyenne de séjour vaut encore 3 à 5 j, et dépend essentiellement du volume cible. Pour de très gros goitres, cette durée peut atteindre encore 10 j[2].
À la sortie, il faut informer le patient sur les mesures de radioprotection à observer éventuellement. Celles-ci concernent notamment la fréquentation de petits enfants et de femmes enceintes. Il faut également avertir le patient sur les problèmes possibles avec les mesures de radioactivité — dans les aéroports, les centrales nucléaires ou l'élimination des déchets — et à l'occasion lui donner un certificat convenable.
Dans certains cas particuliers — par exemple une maladie aiguë du patient qui rend nécessaire un examen et un traitement hors du service de radiothérapie — on peut envisager en Allemagne une sortie avancée. Jusqu'à un débit de dose de 17,5 µSv/h, elle doit être signalée à l'autorité de contrôle, au-dessus, il faut demander une autorisation préalable. Pour le transfert du patient vers un autre service, le responsable de la radioprotection doit veiller à ce que les mesures de radioprotection y soient prises, par exemple qu'une zone contrôlée y soit établie.
Suivi et succès modifier
En Allemagne, le médecin responsable de la radiothérapie est aussi responsable du suivi. « Le médecin spécialiste responsable de la conduite de la radiothérapie doit diriger et noter les effets primaires et secondaires du traitement de radiothérapie, par des consultations de suivi appropriées à intervalles convenables ; éventuellement, il doit prescrire un traitement supplémentaire. Le spécialiste en médecine nucléaire peut confier des parties de ce suivi à un médecin ayant les compétences nécessaires, qui lui rendra compte des résultats de son suivi. Cela n'enlève rien de la responsabilité du spécialiste en médecine nucléaire en ce qui concerne le suivi[6]. »
Selon le type de maladie de la thyroïde traitée, de la situation métabolique et de la prémédication médicamenteuse, les premiers contrôles des paramètres de la thyroïde sont effectués après 4 à 6 semaines, dans le cas de la maladie de Basedow éventuellement plus tôt, pour dépister à temps l'apparition d'une hypothyroïdie. En particulier dans le cas d'orbitopathie endocrine, une fonction insuffisante peut avoir des conséquences adverses, et doit donc être traitée tôt.
Dans la plupart des cas, l'effet définitif de la radiothérapie ne s'établit que dans les premiers trois à six mois, si bien que ce n'est que dans cet intervalle qu'un examen de conclusion doit avoir lieu, pour juger de l'effet de la thérapie et de son succès. Cela comprend d'habitude, outre le dosage des hormones thyroïdiennes, aussi une échographie et une scintigraphie de la thyroïde. Comme dans certains cas, on doit s'attendre à un effet retardé de la radiothérapie même après six mois, il ne faut pas poser trop tôt l'indication pour recommencer la radiothérapie.
Pour les diverses indications de la radiothérapie on note divers buts thérapeutiques et pourcentages de succès. Pour l'autonomie de la thyroïde, le but est l'extinction des nodules toxiques. Pour une dose à l'organe de 300 à 400 Gy, on cite un pourcentage de succès dépassant 90 %. Environ 10 % des patients doivent après la thérapie être traités à long terme avec des hormones thyroïdiennes en raison d'une hypothyroïdie. Pour des toxicoses focales, on peut compter une diminution du volume toxique d'environ 80 %. La diminution du volume de l'ensemble de la thyroïde est de 20 à 50 %[2].
Dans la maladie de Basedow, le but est l'élimination à long terme de l'hyperthyroïdie. Dans la perspective d'une thérapeutique ablative, avec une dose à l'organe de 200 à 300 Gy, le pourcentage de succès dépasse 90 %. Cependant, 80 à 90 % des patients sont ultérieurement dépendants d'une substitution par des hormones thyroïdiennes. Pour la perspective d'optimisation de la fonction, avec une dose à l'organe d'environ 150 Gy, la fraction de succès descend vers 70 %, mais le taux d'hypothyroïdies nécessitant un traitement n'est plus que de 40 %. Ce bas taux de succès n'est pas acceptable, sauf dans des parcours difficiles, avec une hyperthyroïdie difficilement contrôlable par les médicaments, une exophtalmie, ou des récidives répétées, si bien que c'est généralement la thérapeutique ablative qui est utilisée. Pour le procédé de traitement par radiothérapie de résection du goitre, il faut aussi compter en règle générale avec une hypothyroïdie nécessitant un traitement[2].
Le but de la thérapeutique pour le goitre sans hyperthyroïdie est avant tout la diminution du volume de la glande et l'élimination de troubles éventuellement provoqués par la taille du goitre. Pour un volume initial de 50 à 100 ml, on peut compter sur une réduction d'environ la moitié, mais pour de très gros goitres de volume supérieur à 250 ml, on ne peut atteindre une réduction que de 30 à 40 %. Dans plus de 80 % des cas en tout, on obtient une amélioration des troubles[2].
Radiothérapie pour les maladies malignes de la thyroïde modifier
Bases modifier
Les carcinomes épithéliaux de la thyroïde, c'est-à-dire le plus courant des sous-types de carcinomes papillaires (environ 70 %) et le carcinome folliculaire (environ 20 %), et leurs métastases ont encore des ressemblances marquées avec leur tissu d'origine. D'une part, ils expriment le symport Na/I et ont donc une possibilité de stockage de l'iode, d'autre part, ils produisent de la thyroglobuline, ce qui peut servir de marqueur de la tumeur. Les carcinomes de la thyroïde apparaissent souvent comme des nodules froids dans des scintigraphies thyroïdiennes, au sens où leur tendance au stockage de l'iode est moins marquée que dans le tissu thyroïdien sain environnant. Par stimulation avec de hautes concentrations de TSH, les cellules thyroïdiennes cancéreuses conservent leur capacité à stocker l'iode.
Application modifier
Il faut distinguer la radiothérapie à l'iode destinée à éliminer (ablation) de restes éventuellement présents de tissu thyroïdien sain au sens d'une thérapeutique adjuvante destinée à aider et à simplifier les soins de suite, du traitement de restes éventuels de tumeur ou de métastases dans un but de guérison (thérapeutique curative) ou au moins d'allongement de la vie et l'apaisement des douleurs (thérapeutique palliative).
Une indication de la radiothérapie ablative est présente dans presque tous les cas de carcinomes thyroïdiens épithéliaux. Ce n'est que pour le microcarcinome papillaire (dimension inférieure à 1 cm, pT1 N0 M0) que l'on peut dans certains cas renoncer à la radiothérapie ablative[16].
Il n'y a généralement pas d'indication pour la radiothérapie dans les cas de carcinomes thyroïdiens médullaire et anaplastique, car ceux-ci ne stockent pas l'idode en règle générale. La grossesse et l'allaitement sont considérés comme des contre-indications absolues[16].
Préparation modifier
Opération modifier
Avant la radiothérapie pour un carcinome thyroïdien épithélial, on pratique régulièrement une opération sur la thyroïde, la plupart du temps une thyroïdectomie. Il reste presque toujours un petit reste de tissu bénin de thyroïde. Dans des conditions techniquement difficiles d'opération — par exemple un goitre très volumineux ou un patient préalablement opéré — ce reste peut devenir assez grand, ce qui ne représente toutefois aucun inconvénient pour la suite du traitement ou sur les perspectives de survie (pronostic) du patient. C'est pourquoi il n'est pas recommandé de viser une élimination absolument complète de la thyroïde, pour éviter les dommages au nerf laryngé récurrent passant juste derrière la thyroïde[2].
Quand il subsiste des restes de tumeur ou des métastases, ou qu'une récidive locale apparaît, il faut d'abord essayer de réduire chirurgicalement autant que possible la quantité de tissu malin.
Carence en iode modifier
Plus encore que pour la radiothérapie de maladies bénignes de la thyroïde (voir supra), il faut veiller, dans la phase précédant la radiothérapie, à éviter toute arrivée supplémentaire d'iode au patient.
Stimulation du tissu thyroïdien et test à l'iode modifier
Avant la radiothérapie ablative, il faut pratiquer un test à l'iode abrégé (voir supra) de 24 h. Pour une grande absorption, il faut, pour éviter les complications locales, faire la thérapeutique avec une activité diminuée, et prendre en compte la possibilité qu'il pourra être plus tard nécessaire de faire un nouveau traitement pour l'ablation des éventuels restes. Pour une très haute absorption, il faut envisager une deuxième opération pour la diminution du tissu thyroïdien.
Pour augmenter l'absorption d'iode radioactif dans le reste de la thyroïde au cas de thérapeutique ablative, ou pour atteindre au cas de thérapeutique curative ou palliative une absorption notable, les cellules thyroïdiennes laissées doivent être stimulées par un niveau élevé de TSH. La concentration en TSH doit dépasser 30 mU/l[16], la concentration normale s'établissant à 0,4 à 4 µU/l. Cette valeur élevée est atteinte d'habitude en ne traitant pas le patient après l'opération par des hormones thyroïdiennes (substitution), comme on le fait autrement après une thyroïdectomie complète ou une importante élimination de la thyroïde (résection du goitre sub-totale) pour des maladies bénignes. Environ trois à quatre semaines après l'opération, le patient se trouve alors en profonde hypothyroïdie. Cette diminution de la fonction entraîne souvent une incapacité de travail, et il faut avertir le patient qu'il ne doit pas conduire de véhicule ni utiliser de machine dangereuse en raison de ses capacités limitées de réaction.
Comme alternative à la fonction diminuée, on dispose depuis quelques années de TSH recombinante humaine fabriquée génétiquement (rhTSH), qui peut être administrée par injection intramusculaire, et avec laquelle, par des injections en deux jours successifs, le troisième et le quatrième, la concentration de TSH peut dépasser significativement les 30 mU/l.
Comme avantages de l'utilisation de rhTSH vis-à-vis de l'hypothyroïdie peuvent être énumérés : un meilleur bien-être ; une conservation de la capacité de travail ; l'absence d'une stimulation durable de croissance de cellules cancéreuses éventuellement subsistantes par une concentration élevée de la TSH pour plusieurs semaines ; une concentration inférieure du 131I dans le sérum en raison d'un fonction rénale normale — dans l'hypothyroïdie, la fonction rénale est régulièrement passagèrement diminuée — et donc une exposition plus faible au rayonnement. Les taux de succès de la radiothérapie à l'iode sont équivalents avec l'hypothyroïdie et avec la rhTSH[16].
Les inconvénients possibles doivent être évoqués : une demi-vie effective diminuée ; des quantités élevées d'iode non-radioactif dans le corps en raison de l'administration d'hormones thyroïdiennes (iodées) ; le manque de preuve d'équivalence pour le traitement des métastases ; la suppression de la possibilité de faire suivre une thérapie à un diagnostic au radioiode, car le niveau de TSH redescend en quelques jours ; les coûts élevés.
Exécution modifier
L'activité standard pour la radiothérapie à l'iode est de 3,7 GBq. (Ceci correspond dans les anciennes unités à 100 mCi). S'il s'agit de restes de tissu thyroïdien après l'opération et avant la première radiothérapie ablative, on utilise d'habitude une activité inférieure de 1,1 à 1,85 GBq (30 à 50 mCi), pour éviter une inflammation due au rayonnement du tissu voisin.
Dans le cas où il faut supposer — aussi après épuisement des moyens chirurgicaux — qu'il reste du tissu malin dans le corps du patient, un reste de tumeur, une récidive locale ou des métastases, on utilise de plus grandes activités. Celles-ci peuvent se situer dans la fourchette de 3,7 à 11,1 GBq (100 à 300 mCi, et dans certains cas même plus encore.
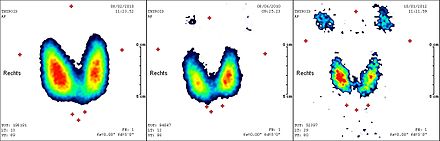
-
Scintigraphie corps entier après une 1re radiothérapie ablative avec 3,7 GBq de 131I. Stockage intensif dans le reste de la thyroïde.
-
…après une 2e radiothérapie ablative avec 3,7 GBq de 131I. Faible stockage dans le reste de la thyroïde.
-
…après une 2e radiothérapie ablative avec 3,7 GBq de 131I. Stockage minimal dans le reste de la thyroïde.
-
Scintigraphie corps entier : test à 131I (370 MBq). Activité physiologique : glandes salivaires, estomac, intestin et vessie. Pas de stockage dans la thyroïde.
Quelques jours après la radiothérapie, on fait une scintigraphie du corps entier. La thérapie sera répétée à des intervalles d'environ 3 mois, jusqu'à ce que ni la scintigraphie, ni l'échographie du cou, ni le marqueur de tumeur thyroglobuline n'indiquent la présence de tissu thyroïdien résiduel (malin ou bénin). Une activité totale pour tous les traitements de radiothérapie jusqu'à 75 GBq (2 000 mCi) est usuellement supportée sans problème par des patients autrement sains. Pour des activités supérieures, il faut envisager un risque de dommages durables à la moelle osseuse fabriquant les cellules sanguines.
En ce qui concerne la sortie après la thérapeutique, les mêmes délais et valeurs limites sont valables que pour les maladies bénignes de la thyroïde (voir supra).
Risques et effets secondaires modifier
Pour les effets indésirables de la radiothérapie, il faut distinguer les effets secondaires immédiats et aigus de ceux à long terme et chroniques, ainsi que leurs fréquence et portée (risques).
Par comparaison avec la thérapeutique de maladies bénignes de la thyroïde, on utilise en partie pour les carcinomes de la thyroïde des activités nettement plus élevées. Avec la plus haute dose à l'organe, souhaitée, il se produit aussi de plus hautes doses de rayonnement dans d'autres tissus.
Il est relativement fréquent que surviennent pendant la radiothérapie une perte d'appétit, un changement de sensation du goût, des nausées et des irritations des glandes salivaires ; on trouve rarement des douleurs ou gonflements du cou, des céphalées ou des changements temporaires de l'hémogramme[17].
Les conséquences à long terme notables sont rares et touchent la plupart du temps les glandes salivaires et lacrymales (production diminuée de salive et de larmes), la moelle osseuse (très rarement, pour des patients de plus de 45 ans, insuffisance médullaire ou leucémie myéloïde chronique), les poumons (très rarement pneumonie provoquée par les radiations, surtout aggravation de pneumonie préexistante, ou récidive par métastases pulmonaires diffuses) et ovaires (ovulation temporairement supprimée, taux de malformation légèrement plus élevé pour une grossesse dans l'année suivant la radiothérapie) ou testicules (azoospermie - rarement durable)[18]. L'utilité de la radiothérapie à l'iode dépasse le taux d'effets secondaires par un facteur 4 à 40. L'incidence attendue de cancers secondaires ou de leucémies dépend de la dose. Une augmentation minimale de cancers secondaires se trouve dans les organes (glandes salivaires, gros intestin et vessie) où le 131I s'accumule passagèrement de façon notable pendant la thérapie[17]. Dans une étude britannique sur 7 417 patients, il s'est avéré une décroissance significative de la survenance des cancers des voies aériennes (bronches et trachée)[17].
Les conséquences indésirables sur les glandes salivaires sont minimisées si le patient mâche du chewing-gum ou suce des bonbons acidulés pendant le traitement. Les deux augmentent le débit de salive, raccourcissent la durée de séjour de l'iode radioactif dans la glande et y diminue donc la dose. Quand une réaction d'inflammation (sialadénite) est provoquée par le rayonnement dans la glande salivaire, les troubles peuvent être calmés par refroidissement local et la prise d'anti-inflammatoirea non stéroïdiens[3].
Suivi : diagnostic à l'iode radioactif modifier
L'iode radioactif ne sert pas seulement au traitement du cancer de la thyroïde, mais aussi au suivi médical après l'opération de la thyroïde et la radiothérapie ablative.
Le déroulement — avec carence d'iode, stimulation de la TSH avec détermination consécutive du marqueur tumoral thyroglobuline, l'administration orale d'iode ainsi que la scintigraphie corps entier — correspond à celui pour la thérapeutique ablative. La différence est la quantité d'activité administrée, habituellement environ 100 à 400 MBq de 131I ou 40 à 200 MBq de 131I.
Une indication pour le diagnostic à l'iode radioactif est en règle générale de 3 à 6 mois après la radiothérapie ablative pour contrôler la thérapie, en cas d'augmentation du marqueur tumoral thyroglobuline ou un autre motif de soupçon (par exemple symptômes cliniques ou imagerie médicale) de récidive du cancer. Pour les patients qui ont été estimés à haut risque en raison de leur diagnostic initial, la question de savoir si et quand il est raisonnable de pratiquer un diagnostic à l'iode radioactif en l'absence de symptôme concret de récidive reste ouverte à la recherche. Il n'existe à ce sujet ni recommandation, ni résultat d'expérience[19].
La démonstration de tissu restant ou de métastases dans le cadre du diagnostic à l'iode radioactif conduit en règle générale à une nouvelle radiothérapie.
Succès et insuccès modifier
Les chances de succès pour des carcinomes de la thyroïde différenciés sont en général très bonnes, en particulier parce qu'elles sont accessibles par la radiothérapie. Pour les patients traités, on indique un taux moyen de survie à 10 ans de plus de 90 % pour le cancer papillaire et d'environ 80 % pour le cancer folliculaire[20],[21]. Les facteurs de pronostic comprennent l'âge du patient, ainsi que la taille, la dissémination et la différenciation histologique de la tumeur ; les métastases dans les ganglions lymphatiques ne semblent pas influer substantiellement sur le pronostic. Mais en raison d'un risque majoré de récidice, un suivi poussé est particulièrement important.
Des études sur de grands nombres de patients et de longues périodes d'observation montrent que la radiothérapie à l'iode abaisse la fréquence des récidives locales ainsi que le risque de mourir du cancer de la thyroïde (létalité), en particulier en cas de traitement de routine après l'opération[22],[23].
Les résultats de la radiothérapie pour les patients possédant déjà des métastases éloignées sont inégales. Les métastases dans le foie ou le poumon, qui stockent l'iode, se traitent bien. Par contre, même les métastases osseuses, qui pourtant aussi stockent bien l'iode, sont à peine influencées. En tout on utilise la radiothérapie pour des métastases quand on ne peut plus soigner chirurgicalement. Mais avant la radiothérapie, il faut essayer de réduire chirurgicalement la masse globale de la tumeur. Si une nouvelle opération était liée à des dommages locaux substantiels, dans certains cas, pour des tumeurs très lentement croissantes, on se déciderait contre une opération suivie de radiothérapie, mais on ne traiterait qu'avec la L-thyroxine[2].
Une situation difficile est celle où les métastases, au cours du traitement, perdent leur capacité à stocker de l'iode (dédifférenciation). Ces métastases ne sont pas reconnues par le diagnostic à l'iode radioactif ni atteintes par la radiothérapie. Pour le diagnostic, on utilise une tomographie par émission de positons (TEP) avec du fluorodésoxyglucose (18F) (FDG). Comme ni la chimiothérapie ni la radiothérapie ne permettent de guérison, on essaie de provoquer une redifférenciation par l'administration d'isotrétinoïne. La radiothérapie à l'iode qui suit présente dans environ 20 à 35 % des cas au moins des succès partiels[2].
Histoire modifier
Avant la mise en jeu de la radiothérapie, on a généralement recouru après l'opération du carcinome de la thyroïde à une irradiation aux rayons X après l'opération, et on la considérait comme efficace[24],[25]. Mais le diagnostic du cancer de la thyroïde soulevait encore au milieu du XXe siècle de grands problèmes[26], si bien que l'on trouve vraisemblablement des chevauchements de concepts dans la littérature de cette époque.
En 1939 et 1940, Joseph G. Hamilton publie des travaux sur le métabolisme de l'iode dans la thyroïde, où il met en œuvre de l'iode radioactif sur des patients sains et d'autres porteurs de goitres d'étiologies variées[27],[28]. Il avait déjà, les années précédentes, effectué des recherches sur l'effet de la radioactivité sur le corps humain[29],[30].
En 1942, Saul Hertz, du Massachusetts General Hospital et le physicien Arthur Roberts publient leur rapport sur la première radiothérapie à l'iode (1941) contre la maladie de Basedow[31],[32], à cette époque encore surtout avec l'isotope 130 (demi-vie 12,4 h)[33]. Quelques mois après, — encore en 1941 — Joseph Hamilton et John H. Lawrence effectuent la première radiothérapie au 131I — l'isotope encore utilisé aujourd'hui[33]. A. S. Keston et collaborateurs rapportent en 1942 une étude de cas d'utilisation d'iode radioactif à but thérapeutique et diagnostique pour une métastase de cancer de la thyroïde sur le fémur, qui n'avait pas répondu à la thérapeutique alors usuelle d'irradiation aux rayons X[34]. Une autre étude de cas de 1942 montre qu'il ne s'agit là pas encore d'une démarche de routine pour le cancer de la thyroïde[35].
Samuel M. Seidlin (1895–1955, alors chef du département d'endocrinologie du Montefiore Hospital à New York) a introduit pour la première fois le 131I pour le cancer de la thyroïde métastasé[36],[37].
En Europe, la première radiothérapie à l'iode pour le cancer de la thyroïde a été effectuée au Luisen-Hospital à Aix-la-Chapelle par Cuno Winkler[38].
Bibliographie modifier
- (de) F. Grünwald et C. Menzel, « Radioiodtherapie », dans T. Kuwert, F. Grünwald, U. Haberkorn, T. Krause, Nuklearmedizin, Stuttgart, New York, (ISBN 978-3-13-118504-4)
- (de) L.-A. Hotze, « Die Geschichte der Radiojodtherapie », (version du sur Internet Archive)
- Institut national du cancer, « Comprendre la radiothérapie », (consulté le )
- Directives médicales :
- (de) DGN, « Radioiodtherapie (RIT) bei benignen Schilddrüsenerkrankungen », sur Deutsche Gesellschaft für Nuklearmedizin, (consulté le )
- (de) DGN, « Verfahrensanweisung zum Radioiodtest », sur Deutsche Gesellschaft für Nuklearmedizin, (consulté le )
- (de) DGN, « Verfahrensanweisung zur Radioiodtherapie (RIT) beim differenzierten Schilddrüsenkarzinom », sur Deutsche Gesellschaft für Nuklearmedizin, (consulté le )
- (de) M. Dietlein, J. Dressler, J. Farahati, F. Grünwald, B. Leisner, E. Moser, Chr. Reiners, H. Schicha, O. Schober, « Verfahrensanweisung für die Iod-131-Ganzkörperszintigraphie beim differenzierten Schilddrüsenkarzinom », sur Deutsche Gesellschaft für Nuklearmedizin, (consulté le )
Voir aussi modifier
Radiothérapie métabolique
Curiethérapie
Radiochirurgie
Radiothérapie externe
Syndrome d'irradiation aiguë
Chimiothérapie
Notes et références modifier
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Radiojodtherapie » (voir la liste des auteurs).
- (de) Frank Grünwald et Karl-Michael Derwahl, Diagnostik und Therapie von Schilddrüsenerkrankungen : Ein Leitfaden für Klinik und Praxis, Frankfurt, Berlin, , 133 p. (ISBN 978-3-86541-538-7, lire en ligne), p. 109
- (de) F. Grünwald et C. Menzel, « Radioiodtherapie », dans T. Kuwert, F. Grünwald, U. Haberkorn, T. Krause, Nuklearmedizin, Stuttgart, New York, (ISBN 978-3-13-118504-4)
- (de) Lothar-Andreas Hotze et Petra-Maria Schumm-Draeger, Schilddrüsenkrankheiten. Diagnose und Therapie, Berlin, (ISBN 3-88040-002-4)
- Radiothérapie à l'iode pour des maladies bénignes de la thyroïde
- (en) M. E. Peterson, « Radioiodine treatment of hyperthyroidism », Clin. Tech. Small Anim. Pract., vol. 21, no 1, , p. 34–39 (ISSN 1096-2867, PMID 16584029)
- (de) « Richtlinie „Strahlenschutz in der Medizin“ (zur StrlSchV) »
- (en) Robert F. Dons,Frank H. Wians, Jr, « Endocrine and Metabolic Disorders: Clinical Lab Testing Manual, Fourth Edition » (consulté le )
- (en) L. D. Marinelli, E. H. Quimby et G. J. Hine, « Dosage determination with radioactive isotopes; practical considerations in therapy and protection. », The American journal of roentgenology and radium therapy, vol. 59, no 2, , p. 260–281 (PMID 18905884)
- Directive d'exécution du test à l'iode radioactif
- (en) I. S. Robertson, « Dosimetry of radionuclides », dans S. Falk, Thyroid disease, New York, Raven, cité dans Grünwald et Menzel 2008
- (en) P. Hall, G. Lundell, A. Mattsson, K. Wiklund, L. -E. Holm, M. Lidberg, J. D. Boice, G. Berg, G. Bjelkengren, U. -B. Ericsson, A. Hallquist et J. Tennvall, « Leukaemia incidence after iodine-131 exposure », The Lancet, vol. 340, no 8810, , p. 1–4 (PMID 1351599, DOI 10.1016/0140-6736(92)92421-B)
- (en) Elaine Ron, Michele Morin Doody, David V. Becker, A. Bertrand Brill, Rochelle E. Curtis, Marlene B. Goldman, Benjamin S. H. Harris III, Daniel A. Hoffman, William M. McConahey, Harry R. Maxon, Susan Preston-Martin, M. Ellen Warshauer, F. Lennie Wong et John D. Boice ((pour le Cooperative Thyrotoxicosis Therapy Follow-up Study Group)), « Cancer Mortality Following Treatment for Adult Hyperthyroidism », JAMA, vol. 280, no 4, , p. 347–355 (PMID 9686552, lire en ligne) (consulté le 06/03/2015)
- (en) American Thyroid Association, « Radioactive Iodine » (consulté le )
- (de) Département fédéral de l'intérieur (Suisse), « Ordonnance sur l'utilisation des sources radioactives non scellées - Art. 37 », sur admin.ch, (consulté le )
- (de) Département fédéral de l'intérieur (Suisse), « Ordonnance sur l'utilisation des sources radioactives non scellées - Annexe 5 », sur admin.ch, (consulté le )
- Directive sur la radiothérapie à l'iode pour le cancer de la thyroïde différencié
- (en) S. M. Chow, « Side effects of high-dose radioactive iodine for ablation or treatment of differentiated thyroid carcinoma », Hong Kong College Radiologist, no 8, , p. 127–135 (lire en ligne) (consulté le impossible )
- (en) D. J. Handelsman, A. J. Conway, P. E. Donnelly et J. R. Turtle, « Azoospermia after iodine-131 treatment for thyroid carcinoma », British Medical Journal, vol. 281, no 6254, , p. 1527 (PMCID 1714914)
- Directive sur la scintigraphie du corps entier à l'iode 131 pour un cancer de la thyroïde différencié
- (de) « Österreichische Gesellschaft für Chirurgische Onkologie: Prognose des differenzierten (papillären, follikulären) Schilddrüsenkarzinoms » (version du sur Internet Archive)
- (de) « Medizinische Universität Wien]: Prognose des differenzierten (papillären, follikulären) Schilddrüsenkarzinoms » (consulté le )
- (en) N. A. Saamann et al., « The results of various modalities of treatment of well differentiated thyroid carcinoma; a retrospective review of 1599 patients », J Clin Endocrinol, vol. 75, , p. 147-54
- (en) E. L. Mazzaferri et S. M. Jhiang, « Longterm impact of initial surgery and medical therapy on papillary and follicular thyroid cancer », Am J Med, vol. 97, , p. 418-28 cité par Grünwald et Menzel 2008
- (en) A. M. Smith, « Carcinoma of the Thyroid », Virginia M. Monthly, vol. 69, , p. 318–324 Abstract dans Cancer Res. 1943; 3: 807 (consulté le= 07/03/2015)
- (en) E. T. Leddy, « The Roentgen Ray Treatment of Malignant Tumors », M. Clin. North Amerika, vol. 25, , p. 973–1009 Abstract dans Cancer Res. 1943; 3: 492 (consulté le= 07/03/2015)
- (af) C. Bonne, « Over Maligne Schildkliergezwellen : (Malignant tumors of the thyroid) », South African M. J., vol. 15, , p. 147–152 Abstract dans Cancer Res. 1943; 3: 349 (consulté le= 07/03/2015)
- (en) Joseph G. Hamilton et Mayo H. Soley, « Studies in iodine metabolism of the thyroid gland in situ by the use of radio-iodine in normal subjects and in patients with various types of goiter », American Journal of Physiology, vol. 131, , p. 135–143
- (en) Joseph G. Hamilton et Mayo H. Soley, « Studies in iodine metabolism by the use of a new radioactive isotope of iodine », American Journal of Physiology, vol. 127, , p. 557–572
- (en) Joseph G. Hamilton et Gordon A. Alles, « The physiological action of natural and artificial radioactivity », American Journal of Physiology, vol. 125, , p. 410–413
- (en) Joseph G. Hamilton, « The rates of absorption of the radioactive isotopes of sodium, potassium, chlorine, bromine, and iodine in normal human subjects », American Journal of Physiology, vol. 124, , p. 667–678
- (en) S. Hertz et A. Roberts, « Application of radioactive iodine in therapy of Graves' disease », J Clin Invest, vol. 21, no 6, , p. 624 cité par (de) Martin Metten, Die Auswirkung der Dosisleistung auf den Therapieerfolg der Radiojodtherapie bei funktionellen Schilddrüsenautonomien : Dissertation, Justus-Liebig-Universität Giessen, (lire en ligne) (consulté le 07/03/2015)
- (de) Ralf Paschke, Hans-Peter Holzapfel, Peter Lamesch et Peter Georgi, « Therapie der uni- oder multifokalen Schilddrüsenautonomie », Dtsch Arztebl., vol. 97, no 47, , A-3197 / B-1245 / C-1168 (lire en ligne) (consulté le 07/03/2015)
- Hotze 2010
- (en) A. S. Keston, R. P. Ball, V. X. Frantz et W. W. Palmer, « Storage of radioactive iodine in a metastasis from thyroid carcinoma », Science, vol. 95, , p. 362–363 (DOI 10.1126/science.95.2466.362) Abstract dans Cancer Res.1943; 3: 344 (consulté le 07/03/2015)
- (en) H. T. Wikle et A. J. Ritzmann, « The course of carcinoma of the thyroid gland. Report of an unusual case », Am J Surg, vol. 5, no 6, , p. 507–512 (DOI 10.1016/S0002-9610(42)90721-9) Abstract dans Cancer Res.1943; 3: 349 (consulté le 07/03/2015)
- (en) S. M. Seidlin, L. D. Marinelli et E. Oshry, « Radioactive iodine therapy: effect on functioning metastases of adenocarcinoma of the thyroid », JAMA, vol. 132, , p. 838
- (en) E. Siegel, « The beginnings of radioiodine therapy of metastatic thyroid carcinoma: a memoir of Samuel M. Seidlin, M.D. (1895-1955) and his celebrated patient », Cancer Biother Radiopharm, vol. 14, , p. 71
- (de) C. Winkler, « Radioaktives Jod zur Behandlung bösartiger Schilddrüsengeschwülste », Verh Dtsch Ges Inn Med, vol. 56, , p. 180 cité par Hotze 2010