Réactif de Nysted
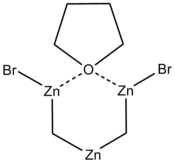
Le réactif de Nysted est un composé chimique de formule C4H8O(BrZnCH2)2Zr. Il s'agit d'un réactif utilisé en synthèse organique pour la méthylénation des groupes carbonyle que la réaction de Wittig ne permet pas de traiter, par exemple en raison d'effets stériques ou de leur tendance à l'énolisation[3]. Découvert par Leonard N. Nysted, d'où son nom, il est peut être utilisé dans ce type de réactions à l'instar du réactif de Tebbe (η5-C5H5)2Ti(µ-CH2)(µ-Cl)Al(CH3)2 ou du dichlorure de zirconocène (η5-C5H5)2ZrCl2. Il peut être obtenu en faisant réagir du dibromométhane CH2Br2 avec du zinc activé dans du tétrahydrofurane (THF)[4]
| Réactif de Nysted | |||
| |||
| Structure du réactif de Nysted | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| Apparence | liquide[1] | ||
| Propriétés chimiques | |||
| Formule | C6H12Br2OZn3 |
||
| Masse molaire[2] | 456,11 ± 0,07 g/mol C 15,8 %, H 2,65 %, Br 35,04 %, O 3,51 %, Zn 43,01 %, |
||
| Propriétés physiques | |||
| Masse volumique | 1,186 g/cm3[1] à 25 °C | ||
| Point d’éclair | −26 °C[1] | ||
| Précautions | |||
| SGH[1] | |||
| H225, H319, H335, H336, H351, EUH019, P201, P202, P210, P233, P305+P351+P338 et P308+P313 |
|||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Au cours d'une alcénation de Nysted, le réactif de Nysted réagit avec le tétrachlorure de titane TiCl4 pour méthyléner un groupe carbonyle. La principale difficulté avec ces réactifs est que leur réactivité n'est pas bien documentée. On pense que le TiCl4 agit comme médiateur dans la réaction. Le réactif de Nysted peut méthyléner différents groupes carbonyle en présence de différents médiateurs. Ainsi, en présence de diéthyléthérate de trifluorure de bore BF3·OEt2, le réactif tend à méthyléner les aldéhydes. En revanche, en présence de TiCl4, TiCl3 ou de TiCl2 et de BF3·OEt2, le réactif peut méthyléner les cétones. Ceci est l'usage principal de ce réactif, en raison de la difficulté générale à méthyléner les cétones ayant un fort encombrement stérique autour du carbonyle.
Le réactif de Nysted est cependant peu étudié en raison de sa grande dangerosité et de sa grande réactivité, qui expliquent la difficulté à le stabiliser pendant son utilisation : il est en particulier susceptible de former des peroxydes explosifs avec l'air et est très inflammable. Il réagit également très violemment avec l'eau. Tout ceci le rend de manipulation délicate[5],[6],[7],[8].
Notes et références modifier
- Fiche Sigma-Aldrich du composé Nysted Reagent, consultée le 29 octobre 2022.
FDS : (en) « Nysted Reagent » [PDF], sur sigmaaldrich.com, Sigma-Aldrich, (consulté le ) - Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Methylenation Reagents » [PDF], Aldrichimica Acta, vol. 26, no 1, sur sigmaaldrich.com, Sigma-Aldrich, (consulté le ), p. 14.
- (en) Leonard N. Nysted pour GD Searle LLC, Brevet U.S. 3865848A : Methylenation reagent, déposé le 5 février 1973, publié le 11 février 1975, sur Google Patents.
- (en) Christophe Aïssa, Ricardo Riveiros, Jacques Ragot et Alois Fürstner, « Total Syntheses of Amphidinolide T1, T3, T4, and T5 », Journal of the American Chemical Society, vol. 125, no 50, , p. 15512-15520 (PMID 14664598, DOI 10.1021/ja038216z, lire en ligne).
- (en) Leo A. Paquette, Ryan E. Hartung, John E. Hofferberth, Ivan Vilotijevic et Jiong Yang, « Synthesis of Stereoisomeric Medium-Ring α,α‘-Dihydroxy Cycloalkanones », The Journal of Organic Chemistry, vol. 69, no 7, , p. 2454-2460 (PMID 15049645, DOI 10.1021/jo0358675, lire en ligne).
- (en) J. Stephen Clark, Thomas C. Fessard et Claire Wilson, « A Concise and Stereoselective Synthesis of the A-Ring Fragment of the Gambieric Acids », Organic Letters, vol. 6, no 11, , p. 1773-1776 (PMID 15151411, DOI 10.1021/ol049483s, lire en ligne).
- (en) David Crich et Abhisek Banerjee, « Stereocontrolled Synthesis of the D- and L-glycero-β-D-manno-Heptopyranosides and Their 6-Deoxy Analogues. Synthesis of Methyl α-L-Rhamno-pyranosyl-(1→3)-D-glycero-β-D-manno-heptopyranosyl- (1→3)-6-deoxy-glycero-β-D-manno-heptopyranosyl-(1→4)-α-L- rhamno-pyranoside, a Tetrasaccharide Subunit of the Lipopolysaccharide from Plesimonas shigelloides », Journal of the American Chemical Society, vol. 128, no 24, , p. 8078-8086 (PMID 16771524, PMCID 2617734, DOI 10.1021/ja061594u, lire en ligne ).



