Pyruvate décarboxylase
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | TPP |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
La pyruvate décarboxylase — à ne pas confondre avec la pyruvate déshydrogénase — est une décarboxylase intervenant dans la fermentation alcoolique de la levure, notamment celle du genre Saccharomyces, dont Saccharomyces cerevisiae (levure de bière) est la plus connue.
Il s'agit d'une enzyme homotétramérique du cytoplasme qui convertit un α-cétoacide en aldéhyde avec élimination d'une molécule de dioxyde de carbone. Dans le processus de fermentation, elle intervient pour convertir le pyruvate CH3-CO-COOH en acétaldéhyde H3C–CHO et CO2, première étape de la biosynthèse de l'éthanol.
Cette enzyme fonctionne avec la thiamine pyrophosphate (TPP) et le cation magnésium Mg2+ comme cofacteurs.
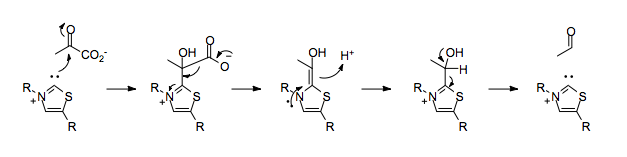
La pyruvate décarboxylase est une enzyme constituée de deux dimères formant un homotétramère pourvu de quatre sites actifs partagés entre les deux monomères de chaque dimère. Ces sites actifs sont situés chacun dans une cavité à l'intérieur de laquelle des liaisons hydrogène peuvent se former et où le pyruvate se lie au TPP. Les monomères de chaque dimère sont étroitement unis entre eux, mais l'interaction entre les dimères est plus lâche. Chacun des monomères est formé de 563 résidus d'acides aminés[1].
Chaque site actif contient 20 résidus d'acides aminés, dont le Glu 477 acide (qui contribue à la stabilité du TPP) et le Glu 52 (qui aide à la fixation du cofacteur). Ces résidus glutamate contribuent également à la formation de l'ylure du TPP, agissant comme donneurs de protons au cycle aminopyrimidine du TPP. L'environnement autour du résidu Glu 477 est très apolaire, conduisant à un pKa plus élevé (le pKa des résidus glutamate et aspartate est normalement de 4,6 dans les petites protéines)[2].
Les résidus hydrophobes Ile 476, Ile 480 et Pro 26 contribuent au caractère a polaire de la région du Glu 477. L'Asp 28 est l'autre résidu chargé négativement dans la région, qui contribue également à accroître le pKa du résidu Glu 477.
Notes et références modifier
- (en) Fred Dyda, William Furey, Subramanyam Swaminathan, Martin Sax, Bruce Farrenkopf et Frank Jordan, « Catalytic centers in the thiamin diphosphate dependent enzyme pyruvate decarboxylase at 2.4-.ANG. resolution », Biochemistry, vol. 32, no 24, , p. 6165–6170 (lire en ligne) DOI 10.1021/bi00075a008
- (en) Mario Lobell et David H. G. Crout, « Pyruvate Decarboxylase: A Molecular Modeling Study of Pyruvate Decarboxylation and Acyloin Formation », Journal of the American Chemical Society, vol. 118, no 8, , p. 1867-1873 (lire en ligne) DOI 10.1021/ja951830t
