Ionone
| Ionone | |
| |
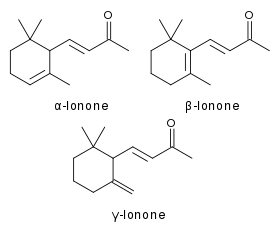
| Les trois formes de l'ionone (alpha-, bêta- et gamma-ionone). | |
| Identification | |
|---|---|
| No CAS | (mélange) (α) (β) (γ) |
| No CE | 232-396-8 (mélange) 204-841-6 (α) 201-224-3 (β) |
| FEMA | 2594, 2595 |
| Propriétés chimiques | |
| Formule | C13H20O [Isomères] |
| Masse molaire[1] | 192,297 3 ± 0,012 1 g/mol C 81,2 %, H 10,48 %, O 8,32 %, |
| Propriétés physiques | |
| T° ébullition | 127 °C |
| Masse volumique | 0,9351 à 20 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'ionone (ou 4-(2,6,6-triméthyl-1-cyclohexène-1-yl)-3-butène-2-one) est un composé chimique de formule C13H20O, appartenant à la famille des terpènes et des composés odorants. À température ambiante, il s'agit d'un liquide jaune pâle à l'odeur boisée et fruitée. Il s'agit d'un des composés de base de la production de rétinol. Elle est un mélange de deux formes : α-ionone et β-ionone qui peuvent être synthétisées à partir du citral et de l'acétone. L'ionone de synthèse a été obtenue pour la première fois en 1893 par Wilhelm Haarmann[2], et par Georg Merling en 1909[3],[4].
- L'α-ionone a une odeur fruitée verte et boisée de cèdre et de framboise, ne pas confondre avec la frambinone.
Elle est issue de la dégradation des molécules de carotène présentes dans l'herbe coupée ou le foin. L'α-ionone est le composant parfumé naturel de l’essence de violette, obtenu par extraction des solvants. L’essence de violette naturelle est trop coûteuse pour servir de matière première, aussi la plupart des molécules d’ionone utilisées en parfumerie et dans l’industrie des additifs alimentaires sont fabriquées industriellement (le terme exact n'est pas additifs mais arômes, les arômes alimentaires n'étant pas inclus dans la liste des additifs alimentaires suivant la législation européenne directive 88/388/CEE et le règlement (CE) N 1334/2008).
- La β-ionone possède une douce odeur de violette, cette molécule étant souvent très délicate à percevoir (50% de la population ne la perçoivent pas)
Notes et références modifier
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- John Emsley (trad. de l'anglais), Guide des produits chimiques à l'usage du particulier, Paris, Odile Jacob, , 336 p. (ISBN 2-7381-0384-7), p. 17.
- (de) Georg Merling et Robert Welde, « Synthese von Veilchenriechstoffen », Liebigs Ann., vol. 366, nos 1-2, , p. 119-216.
- (de) Freddy Litten, « Georg Merling : Kurzbiographie », dans Professorenkatalogs, vol. 2, Munich, université Louis-et-Maximilien, (lire en ligne).