Effet de cage
En chimie, l'effet de cage est un phénomène qui décrit comment les propriétés d'une molécule sont affectées par ce qui l'entoure. Introduit à l'origine par Franck et Rabinovitch[1] en 1934, l'effet de cage suggère qu'au lieu d'agir comme une entité individuelle, les molécules dans un solvant sont plutôt décrites comme une entité encapsulée[2],[3]. Afin d'interagir avec d'autres molécules, la particule en cage doit se répandre hors de sa cage de solvant. La durée de vie classique d'une cage de solvant est de 10−11 s[4].
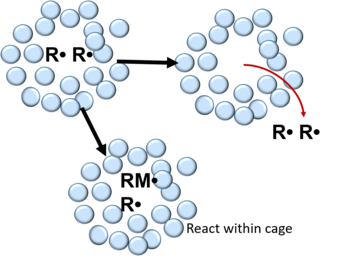
Lors de la polymérisation radicalaire, les radicaux libres formés lors de la décomposition d'un amorceur sont encerclés par une cage faite de solvant et/ou de monomères[3]. Au sein de cette cage, les radicaux subissent plusieurs collisions qui mènent à leur recombinaison ou bien une désactivation mutuelle[2],[3],[5]. Cela peut être décrit selon la réaction suivante[5] :
Après recombinaison, les radicaux peuvent soit réagir avec des monomères composant le pourtour de la cage ou bien diffuser librement hors de la cage. Pour les polymères, la probabilité qu'un radical s'apparie pour échapper à la recombinaison au sein de la cage est de l'ordre de 0,1 à 0,01 et de l'ordre de 0,3 à 0,8 dans les liquides[2].
Efficacité de recombinaison au sein de la cage modifier
L'effet de cage peut être quantitativement décrit avec l'efficacité de recombinaison de cage Fc , défini comme suit[5] :
Ici, Fc est défini comme le rapport entre la constante de recombinaison de cage (kc) et la somme des constantes de tous les processus au sein de la cage[5]. D'après les modèles mathématiques, Fc est dépendant des changements de plusieurs paramètres dont la taille du radical, sa forme, et la viscosité du solvant[5],[6],[7]. Il a été constaté que l'effet de cage augmente avec l'augmentation de la taille du radical et la diminution de la masse du radical.
Efficacité de l'amorceur modifier
Lors de la polymérisation radicalaire, le taux d'amorçage est dépendant de l'efficacité de l'amorceur[3]. La faible efficacité de l'amorceur, ƒ, est largement attribuée à l'effet de cage. Le taux d'amorçage est défini comme suit[3] :
où Ra est le taux d'amorçage, kd est la constante de dissociation de l'amorceur et [A] est la concentration initiale de l'amorceur. L'efficacité de l'amorceur représente la fraction de radicaux primaires R•, qui contribue en réalité à l'amorçage de la chaîne. À cause de l'effet de cage, les radicaux peuvent subir une désactivation mutuelle qui engendre des produits stables au lieu d'initier la propagation, ce qui réduit la valeur de ƒ[3].
Références modifier
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cage effect » (voir la liste des auteurs).
- (en) J. Franck et E. Rabinowitsch, « Some remarks about free radicals and the photochemistry of solutions », Transactions of the Faraday Society, vol. 30, no 0, (ISSN 0014-7672, DOI 10.1039/TF9343000120, lire en ligne, consulté le )
- (en) E. T. Denisov, « Cage effects in a polymer matrix », Die Makromolekulare Chemie, vol. 8, no S19841, , p. 63–78 (ISSN 0025-116X, DOI 10.1002/macp.1984.020081984106, lire en ligne, consulté le )
- (en) Manas Chanda, Introduction to Polymer Science and Chemistry : A Problem-Solving Approach, Second Edition, CRC Press, , 770 p. (ISBN 978-1-4665-5384-2, lire en ligne)
- L. Herk, M. Feld et M. Szwarc, « Studies of Cage Reactions », Journal of the American Chemical Society, vol. 83, no 14, , p. 2998–3005 (ISSN 0002-7863, DOI 10.1021/ja01475a005, lire en ligne, consulté le )
- Dale A. Braden, Eileen E. Parrack et David R. Tyler, « Solvent cage effects. I. Effect of radical mass and size on radical cage pair recombination efficiency. II. Is geminate recombination of polar radicals sensitive to solvent polarity? », Coordination Chemistry Reviews, vol. 211, no 1, , p. 279–294 (DOI 10.1016/S0010-8545(00)00287-3, lire en ligne, consulté le )
- Richard M. Noyes, « A Treatment of Chemical Kinetics with Special Applicability to Diffusion Controlled Reactions », The Journal of Chemical Physics, vol. 22, no 8, , p. 1349–1359 (ISSN 0021-9606, DOI 10.1063/1.1740394, lire en ligne, consulté le )
- (en) Richard M. Noyes, « Effects of diffusion rates on chemical kinetics. », Progress in reaction kinetics and mechanism, vol. 1, , p. 129-160
