Cyclol
Le mécanisme cyclol est le premier modèle structural d'une protéine globulaire[1]. Il a été imaginé par Dorothy Wrinch à la fin des années 1930, et repose sur trois hypothèses :
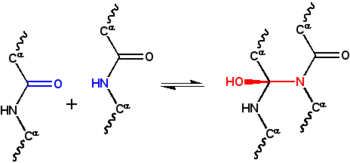
- d'abord, que deux groupes peptides peuvent se recombiner par une réaction cyclol (Figure 1); ce mécanisme est une version covalente de la liaison par pont hydrogène entre groupes peptide. Ces réactions avaient été observées sur des ergopeptides et d’autres composés ;
- deuxièmement que, sous les mêmes conditions, les acides aminés engendrent spontanément le plus possible de combinaisons cyclol, donnant naissance à des molécules cyclol (Figure 2) et des composés cyclol (Figure 3). Ces molécules et composés cyclol n'ont jamais été observés ;
- finalement, l'hypothèse pose que les protéines globulaires ont une structure tertiaire affectant celles de solides platoniciens ou de polyèdres semi-réguliers formés de composés cyclol saturés. On n'a jamais observé non plus de telles molécules.
Bien que les données recueillies depuis aient montré que ce modèle de structure des protéines globulaires devait être rectifié, plusieurs de ses prédictions ont été vérifiées : non seulement l'existence de la réaction cyclol elle-même, mais aussi l'hypothèse selon laquelle les interactions hydrophobes sont essentiellement responsables du repliement des protéines. Le mécanisme cyclol a stimulé de nombreux chercheurs dans l'étude de la structure et la chimie des protéines, et il est à la base de la plupart des interprétations de la double hélice de l'ADN et la structure secondaire des protéines. Enfin l'histoire des débats autour du modèle illustre comment les réfutations empiriques vivifient la méthode scientifique.
Contexte historique modifier
Au milieu des années 1930, les études analytiques par ultracentrifugation de Theodor Svedberg avaient montré que les protéines ont une structure chimique bien définie, et ne sont pas de simples agrégats de molécules plus petites[2]. Ces mêmes études semblaient indiquer que le poids moléculaire des protéines permet de les classer par poids multiples communs de deux entiers[3], de la forme Mw = 2p3q Da, où p et q sont deux entiers positifs[4]. Cela dit, il était délicat de déterminer le poids moléculaire exact et le nombre d'acides aminés d'une protéine. Svedberg avait aussi montré qu'en changeant de solvant, on pouvait décomposer une protéine en molécules moins lourdes, ce qu'on qualifie aujourd'hui de modification de structure quaternaire[5].
La structure chimique des protéines était encore controversée à l'époque[6]. L'hypothèse la plus généralement reçue (et qui s'avéra finalement correcte) était que les protéines sont des polypeptides linéaires, c'est-à-dire des polymères d'acide aminés non-ramifiés, connectés par liaisons peptides[7],[8]. Mais une protéine est une chaîne comportant typiquement des centaines de brins d'acides aminés — et plusieurs chercheurs éminents (au rang desquels Emil Fischer) doutaient alors de la stabilité en solution de macromolécules linéaires aussi longues[9],[10]. De nouveaux doutes s'élevèrent sur la nature polypeptidique des protéines car certaines enzymes décomposent les protéines mais non les peptides, tandis que d'autres enzymes décomposent les peptides mais non les protéines repliées[11]. Les tentatives de synthèse de protéines in vitro s'avérèrent vaines, à cause de la chiralité des acides aminés, car les protéines naturelles ne comportent que des acides aminés lévogyres. C'est pourquoi on se mit à rechercher de nouveaux modèles chimiques de protéines : ainsi l'hypothèse diketopiperazine d'Emil Abderhalden[12],[13]. Toutefois, aucun autre modèle n'a à ce jour permis d'expliquer pourquoi les protéines ne donnent que des acides aminés et des peptides par hydrolyse et protéolyse. Comme Linderstrøm-Lang l'a mis en évidence[14], ces résultats de protéolyse montraient que les protéines dénaturées sont des polypeptides, mais on n'avait encore aucune information sur la structure des protéines repliées ; aussi, la dénaturation pouvait résulter d'une transformation chimique convertissant les protéines repliées en polypeptides.
Le processus de dénaturation des protéines (en tant que distinct de la coagulation) avait été découvert en 1910 par Harriette Chick et Charles James Martin[15], mais sa nature restait mystérieuse. Tim Anson et Alfred Mirsky avaient démontré que la dénaturation est un processus réversible à deux états[16] qui affecte des groupes chimiques disponibles pour des réactions chimiques, notamment la décomposition par des enzymes[17]. En 1929, Hsien Wu a formulé l’hypothèse correcte selon laquelle la dénaturation correspond au dépliement de protéine, un pur changement de forme qui cependant rend les chaînes d'acides aminés vulnérables au solvant[18]. L'hypothese de Wu avait d'ailleurs été formulée indépendamment en 1936 par Mirsky et Linus Pauling[19] ; néanmoins, les biologistes ne pouvaient exclure que la dénaturation corresponde à une transformation chimique de la protéine[17], une hypothèse parmi d'autres qui ne tomba en discrédit qu'à la fin des années 1950[20],[21].
La cristallographie aux rayons X venait juste de se constituer en discipline en 1911, et son champ d'application, d'abord limité aux « sels » cristallins, progressait rapidement, jusqu'à permettre d'analyser des molécules complexes comme le cholestérol ; toutefois, même les plus petites protéines comptent plus de 1 000 atomes, ce qui fait de la détermination de leur structure un puzzle redoutable. Ainsi, les données cristallographiques d'une petite protéine, l'insuline, avaient été obtenues dès 1934 par Dorothy Crowfoot Hodgkin, mais sa structure ne sera élucidée qu'à la fin des années 1960. Toujours est-il que dès les années 1930, les résultats de cristallographie aux rayons X avaient été obtenus pour une multitude de protéines fibreuses naturelles comme celles de la laine ou des cheveux (kératine) : William Astbury avait proposé de les interpréter à partir de structures secondaires comme le modèle de l'« hélice alpha » ou du « feuillet bêta. »
En ces années 1930, non seulement la structure des protéines restait incomprise, mais c'était aussi le cas pour les interactions physiques qui assuraient sa stabilité. Astbury supposait que la structure des protéines fibreuses restait stable grâce à l'action de liaisons par pont hydrogène agissant sur des feuillets bêta[22],[23]. Dorothy Jordan Lloyd avança à son tour que les protéines globulaires sont stabilisées par des liaisons par pont hydrogène[24],[25] en 1932, et cette théorie sera reprise plus tard par Alfred Mirsky et Linus Pauling[19]. Mais à la fin d'une conférence prononcée en 1933 devant l’Oxford Junior Scientific Society par Astbury, le physicien Frederick Frank émit l'hypothèse que la protéine fibreuse d'α-kératine pourrait être stabilisée par un autre mécanisme : une hybridation covalente des peptides par la réaction cyclol[26] : l'hybridation cyclol rapprochant deux groupes peptides, les atomes d'azote et de carbone ne seraient plus distants que d'environ 1,5 Å, alors qu'ils sont distants d'environ 3 Å dans le cas d'une liaison par pont hydrogène. Cette idée intrigua J. D. Bernal au point qu'il invita la mathématicienne Dorothy Wrinch à explorer les structures géométriques compatibles avec ce mécanisme.
La théorie d'origine modifier
Wrinch va bientôt faire de cette hypothèse un modèle intégré de la structure des protéines. Elle présente le mécanisme cyclol fondamental dans son premier article[27] (1936). Elle montrait la possibilité de conformer des polypeptides en cycles pour former des anneaux (ce qui a été confirmé) et suggérait que ces anneaux pouvaient être le siège de recombinaisons internes via une réaction dite cyclol (ce qui arrive, quoique rarement). S'appuyant sur l'hypothèse que la forme cyclol de la liaison peptide est plus stable que la forme amide, Wrinch concluait que certains peptides cycliques développent spontanément le plus de liaisons cyclol possible (comme le cyclol 6 de la figure 2). En supposant, en outre, que les liaisons chimiques préservent les mêmes longueurs de chaîne, en gros 1,5 Å, les molécules cyclol devaient présenter une symétrie hexagonale; à titre de comparaison, les liaisons N-C et C-C ont des longueurs de 1,42 Å et 1,54 Å, respectivement.
Ces anneaux peuvent être allongés indéfiniment pour former un composé cyclol (figure 3). De tels composés présentent a arrangement quasi-cristallin de longue période, que Wrinch pensait convenir pour décrire les protéines, puisqu'elles doivent agréger de manière compacte des centaines de brins aminés. Autre aspect intéressant de ces molécules ou composés : leurs branches en chaînes d'acides aminés ne font saillie que sur une face ; la face opposée n'a pas de chaînes hors-plan. Ainsi, une face est complètement indépendante de la séquence primaire du peptide, dont Wrinch pensait qu'elle pourrait expliquer les indépendances de séquence des protéines.
Dans son premier article, Wrinch affirmait nettement que le mécanisme cyclol n'était qu'une hypothèse de travail, un modèle potentiellement valide pour la structure des protéines qui, par conséquent, devait être corroboré aux observations ; mais au bout de quelques années, les expériences et l'apparition de modèles concurrents ont montré que ce mécanisme était une hypothèse intenable dans le cas des protéines globulaires.
Le problème de la stabilité modifier
Dans deux lettres à l'éditeur de Nature[28],[29] (1936), Wrinch et Frank s'interrogeaient sur la stabilité des formes cyclol et amide des peptides. Un calcul élémentaire montre que la forme cyclol est sensiblement moins stable que l'autre ; par conséquent, il aurait fallu abandonner l'hypothèse cyclol, à moins d'identifier une source d'énergie spécifique à effet stabilisant. Initialement, Frank avança que le cyclol développait des interactions spécifiques avec le solvant ; parla suite, Wrinch et Irving Langmuir formulèrent l'hypothèse selon laquelle c'est l'association hydrophobe de chaînes secondaires non-polaires qui apporte l'énergie suffisante pour permettre les réactions cyclol[30],[31].
La volatilité de la liaison cyclol était considérée comme un intérêt du modèle, puisqu'il expliquait les phénomènes de dénaturation ; la réversibilité des liaisons cyclol vers leur forme amide plus stable permet d'ouvrir leur structure et expose ces liaisons à l'action des protéases, ce qui est conforme aux expériences[32],[33]. Des études préalables avaient montré que les protéines dénaturées par un changement de pression sont souvent dans un état différent des mêmes protéines dénaturées par les hautes températures, ce qui a été interprété comme favorable au modèle cyclol de dénaturation[34].
Mais l'hypothèse de Langmuir-Wrinch de la « stabilisation hydrophobe » tomba en discrédit au même moment que l'hypothèse cyclol, et cela surtout à l'instigation de Linus Pauling, qui privilégiait l’hypothèse de stabilisation structurale des protéines par ponts hydrogène. Il faudra attendre encore une vingtaine d'années avant que les « interactions hydrophobes » soient reconnues comme l'un des moteurs essentiels du repliement des protéines[35].
Complémentarité stérique modifier
Dans un troisième article sur les cyclols[36] (1936), Wrinch remarquait que plusieurs substances « actives physiologiquement » comme les stéroïdes sont composées d'anneaux hexagonaux de carbone agrégés, et qu'elles pouvaient offrir une complémentarité stérique avec les faces de molécules cyclol sans branches d'acides aminés. Wrinch estima dès lors que cette complémentarité stérique était l'un des principaux critères pour qu'une molécule viennent se combiner à une protéiné.
Wrinch alla jusqu'à avancer que les protéines sont à l'origine de toutes les synthèses de molécules biologiques. Et même, se fondant sur le fait que les cellules ne décomposent leurs propres protéines qu'en cas d'extrême carence de nutriments, que la vie ne pouvait exister sans protéines.
Modèles hybrides modifier
Dès ses débuts, la réaction cyclol avait été considérée comme une « version covalente » de la liaison par pont hydrogène. L'idée paraissait donc naturelle de former des modèles hybrides combinant ces deux types de liaison chimique. Cela fournit la matière du quatrième article de Wrinch sur le modèle cyclol[37] (1936), écrit en collaboration avec Dorothy Jordan Lloyd, qui avait suggéré que les protéines globulaires étaient stabilisées par des ponts hydrogène[24]. Un second article fut publié en 1937, qui citait d'autres auteurs partisans de la liaison par pont hydrogène dans les protéines, tels Maurice Loyal Huggins et Linus Pauling[38].
Wrinch écrivit aussi un article avec William Astbury, concernant la possibilité de l'isomérisatio keto-enol du >CαHα avec un groupe amide carbonyle >C=O, produisant une hybridation >Cα-C(OHα)< et dans laquelle l'oxygène était remplacé par un radical hydroxyle[39]. Ces réactions pouvaient développer des cycles à cinq embranchements, là où l'hypothèse cyclol classique en annonçait six ; mais cette hypothèse kéto-énol n'alla pas plus loin[40].
Composés sphéroïdes modifier
Dans son cinquième article sur les cyclols[41] (1937), Wrinch énonça les conditions dans lesquelles deux composés cyclols plans pouvaient se combiner pour former une molécule non-plane. Tenant compte des angles imposés par les liaisons chimiques, elle proposa une simplification mathématique consistant à représenter les agrégats en anneaux de six molécules non-planaires par un hexagone dont les sommets sont les milieux des liaisons chimiques, et occupant le plan moyen des molécules. Cette représentation permet de voir clairement que les composés cyclols plans peuvent se combiner sous réserve que l’angle dièdre entre les plans soit celui du tétraèdre régulier (angle δ = arccos(-1/3) ≈ 109.47°).
Or on peut construire un grand nombre de polyèdres respectant ce critère, à commencer par le tétraèdre tronqué, l’octaèdre, et l’octaèdre tronqué, qui sont des solides platoniciens ou polyèdres semi-réguliers. N’examinant que la première collection des cyclols fermés (ceux construits en tétraèdre tronqué), Wrinch put établir que le nombre d’acides aminés présents dans la chaîne croît quadratiquement (~72n2, où n est l’indice du composé cyclol Cn). Ainsi, le cyclol C1 possède 72 brins d’acides aminés, le cyclol C2, 288 brins, etc. Les premiers indices expérimentaux à l’appui de cette prédiction vinrent de Max Bergmann et Carl Niemann[4], dont les dénombrements d’acides aminés dans les protéines donnaient des entiers multiples de 288 (n=2). Plus généralement, le modèle cyclol se fondait sur les résultats pionniers d’analyse par ultracentrifugation de Theodor Svedberg, lesquels suggéraient que le poids moléculaire des protéines permettait de les répartir en deux classes[2],[3].
Le modèle cyclol était donc compatible avec les propriétés connues des protéines globulaires[42].
- Les analyses par centrifugation montraient que les protéines globulaires sont sensiblement plus denses que l'eau (~1,4 g/ml) et qu'elles sont un arrangement dense de radicaux ; Wrinch a supposé qu'« arrangement dense » impliquait « arrangement régulier. »
- Malgré leurs dimensions importantes, certaines protéines cristallisent d'emblée sous forme de cristaux symétriques, ce qui est compatible avec l'idée de faces symétriques qui se superposent dans les combinaisons chimiques.
- Les protéines captent les ions métalliques ; et puisque les sites de fixation des ions métalliques doivent s'accommoder d'angles de liaison spécifiques (par ex. ceux de l’octaèdre régulier), il est vraisemblable que la totalité de la proteine affecte une géométrie cristalline.
- Comme cela a été indiqué ci-dessus, le modèle cyclol fournit une explication simple chimique de la dénaturation et de la difficulté de dissoudre des protéines globulaires avec des protéases.
- On estimait dans les années 1930 que les protéines sont responsables de la synthèse de toutes les molécules biologiques, à commencer par les protéines complexes. Wrinch relevait qu'une structure fixe et uniforme était favorable à la recombinaison, comme le montre le mécanisme de réplication dans la conception de l'ADN de Francis Crick et Watson. Étant donné que nombre de molécules biologiques ont une structure hexagonale, comme les sucres et les stérols, il est vraisemblable que leur protéines-mères ont elles-mêmes une structure hexagonale. Wrinch a résumé son modèle et rappelé les mesures de poids moléculaire qui le confirment dans trois articles de synthèse[43].
Premières applications modifier
Disposant désormais d'un modèle théorique expliquant la structure des protéines globulaires, Wrinch entreprit de l'appliquer aux données cristallographiques disponibles. Elle parvint ainsi à la conclusion que la protéine de la tuberculose bovine (523) devait être un cyclol fermé C1 composé de 72 résidus aminés[44] et l'enzyme digestive pepsine, un cyclol fermé C2 composé de 288 résidus aminés[45],[46]. Il était difficile de vérifier ces nombres, car les méthodes de mesure de la masse des protéines, telles l'analyse par ultracentrifugation ou les pesées chimiques étaient encore fort imprécises.
Wrinch déduisit également que l'insuline doit être un cyclol fermé C2 formé de 288 résidus. Or on disposait de quelques résultats précis de cristallographie aux rayons X pour l'insuline, que Wrinch interpréta comme confirmant son modèle[47] ; cette interprétation, toutefois, fut généralement jugée prématurée[48]. L'examen soigné que fit Dorothy Crowfoot Hodgkin des diagrammes de Patterson de l'insuline montra qu'ils étaient à peu près compatibles avec le modèle cyclol, mais insuffisamment toutefois pour confirmer l'exactitude du modèle[49].
Réfutation modifier
Le mécanisme cyclol a été battu en brèche pour plusieurs raisons. D'abord Hans Neurath et Henry Bull ont montré que la densité de chaînes secondaires des cyclols était incompatible avec la densité mesurée dans les films de protéine[50]. Puis Maurice Huggins calcula que plusieurs atomes non-liés du composé cyclol devaient être plus rapprochés que ce qu'autorise leur rayon de van der Waals : par exemple, pour les atomes intérieurs de Hα et Cα, les lacunes n'ont que 1,68 Å d'ouverture[51] (Figure 5). Haurowitz a montré par des analyses chimiques que l'enveloppe extérieure des protéines ne pouvait comporter beaucoup de radicaux hydroxyles, contrairement à ce qu'annonçait le modèle cyclol[52]. Simultanément, Meyer et Hohenemser établissaient l'absence de condensats cyclol d’acides aminés, même en quantités minuscules ou en état de transition[53]. Bergmann et Niemann[54], ainsi que Neuberger[55],[56]. ont apporté des arguments plus classiques contre ce modèle cyclol. La spectroscopie infrarouge a permis d'établir que le nombre de radicaux carbonyles dans une protéine est invariant par hydrolyse[57], et que les protéines repliées intactes sont saturées en amide carbonyles[58] ; ces deux dernières observations contredisent l’hypothèse cyclol, selon laquelle les carbonyles sont convertis en hydroxyles dans les protéines repliées. Enfin, on sait que les protéines contiennent des prolines en quantités appréciables (typiquement 5%); et comme il manque à la proline l’hydrogène amide et que son noyau d'azote forme déjà trois liaisons covalentes, les prolines paraissent impropres à la réaction cyclol et ne peuvent s'agréger à un composé cyclol. Pauling et Niemann ont fait l'inventaire de l'ensemble des preuves chimiques et structurales s'opposant au modèle cyclol[59]. Enfin, l'argument à l'appui du mécanisme cyclol, à savoir que toutes les protéines[4] comportent un nombre de résidus d'acides aminés multiple de 288, a été réfuté[60] en 1939.
Wrinch s'efforça de répondre point par point aux objections. Pour ce qui est de l'encombrement stérique, elle observait que de petites déformations des angles entre liaisons et portée des liaisons suffisent à éviter les contacts ou du moins à en réduire le nombre[61]. Elle faisait également observer que les distances entre radicaux non-liés à l'intérieur d'une molécule peuvent être inférieurs à leurs rayons de van der Waals : ainsi, la distance entre radicaux méthyls n'est que de 2,93 Å dans l'hexaméthylbenzène. Concernant le seuil d'activation de la réaction cyclol, Wrinch contestait les calculs de Pauling et déclara que les énergies intramoléculaires étaient trop mal connues pour qu'on puisse écarter sur cette seule base la validité du modèle[61]. En réponse aux objections proprement chimiques, Wrinch signala que les réactions bimoléculaires étudiées pouvaient ne pas se rapporter au modèle cyclol, et que l'encombrement stérique pouvait suffire à empêcher la recombinaison des hydroxyles superficiels[62]. Quant au nombre de residus d'acides aminés, Wrinch généralisa son modèle pour qu'il donne d'autres multiples que ceux de 288 : en particulier, parvint à construire un modèle théorique "minimal" de cyclol fermé ne comportant que 48 résidus[63] et sur cette base (incorrecte), elle a été la première à estimer le poids moléculaire de l'insuline monomère à environ 6 000 Da[64],[65].
Elle continua donc de soutenir que le modèle cyclol était encore potentiellement viable pour les protéines globulaires[66],[67] et même suggéra la présence de composés cyclols dans le cytosquelette[68] ; mais la plupart des biochimistes avaient cessé d'y croire, et Wrinch se consacra désormais aux problèmes mathématiques posés par la cristallographie aux rayons X, à la solution desquels elle a beaucoup contribué. Toutefois, la physicienne Gladys Anslow, collègue de Wrinch à Smith College, qui étudia les spectres d'absorption ultraviolet des protéines et des peptides dans les années 1940 et admit la possibilité d'interpréter ses résultats grâce au mécanisme cyclol[69],[70]. Au moment où Frederick Sanger commençait à élucider la séquence de l'insuline, Anslow publia un modèle cyclol tridimensionnel comportant des chaînes secondaires[71] inspiré pour l'essentiel du modèle « cyclol minimal[63] » de Wrinch (1948).
Réhabilitation partielle modifier
La réfutation du modèle cyclol s'est généralement accompagnée du rejet de ses différents aspects ; une exception notable aura été l'intérêt éphémère du cristallographe J. D. Bernal pour l’hypothèse de Langmuir-Wrinch, selon laquelle le repliement des protéines est lié à l'association hydrophobe[73]. Néanmoins, on a pu, dans les années 1950, reconnaître l'existence de liaisons cyclol dans de petites molécules de peptides cycliques.
Une clarification de la terminologie est ici nécessaire. La réaction cyclol classique est l'addition de l'amine NH d'un groupe peptide au radical carbonyle C=O d'un autre peptide ; le produit de la réaction est appelé un azacyclol. Par analogie, un oxacyclol est formé lorsqu'un radical hydroxyle OH fait une addition avec un carbonyle peptidyl. De même, le thiacyclol se forme par addition d'un radical thiol SH avec un carbonyle peptidyl[74].
L'alcaloïde ergotamine oxacyclol extrait du champignon Claviceps purpurea est le premier cyclol jamais identifié[75]. Le depsipeptide cyclique serratamolide est lui aussi formé par une réaction oxacyclol[76]. On a également obtenu des thiacyclols cycliques chimiquement similaires[77], et on a observé des azacyclols classiques dans de petites molécules[78] et des tripeptides[79]. Les peptides sont produits naturellement par décomposition des azacylols[80], ce qui est une conséquence directe du mécanisme cyclol. Des centaines de molécules cyclol ont pu être identifiées, malgré les calculs de seuil d'activation de Linus Pauling[59].
Après un long silence, au cours duquel elle s'était principalement consacrée aux mathématiques de la cristallographie aux rayons X, Wrinch salua ces découvertes avec un enthousiasme redoublé pour le modèle cyclol[81]. Elle consacra deux traités à l'exposé du mécanisme cyclol et aux petits peptides en général[82],[83].
Une leçon de méthode modifier
Le modèle cyclol pour la structure des protéines illustre bien le processus dialectique dans la méthode scientifique. Une hypothèse originale tenant compte d'observations expérimentales inexpliquées, est d'abord formulée ; les conséquences de cette hypothèse sont tirées, notamment certaines prédictions qui sont à leur tour soumise à l’expérience. Dans le cas présent, l'hypothèse-clef est qu'il faut privilégier la forme cyclol des peptides sur la forme amide. Cette hypothèse prédit l'existence de la molécule de cyclol-6 et le composé cyclol, qui confèrent aux protéines globulaires la forme de polyèdres semi-réguliers. Une des prédictions vérifiables de la théorie est que les radicaux carbonyles d'une protéine repliée devraient se convertir majoritairement en radicaux hydroxyles ; or les résultats aussi bien spectroscopiques que chimiques montrent que cela n'est pas exact. Le modèle cyclol implique également une densité élevée d'acides aminés dans les chaînes secondaires des protéines repliées et dans les films de protéines, ce qui est démenti par l'expérience. Par conséquent, le modèle cyclol doit être rejeté et il faut formuler de nouvelles hypothèses pour la structure des protéines : c'est ainsi qu'apparaissent les modèles de l'hélice alpha proposée dans les années 1940 et 1950.
On a pu écrire[84],[85] que l'hypothèse cyclol aurait d'emblée dû être écartée en raison de ses contradictions évidentes, à savoir l'encombrement stérique, son incapacité à intégrer les acides prolines, et une énergie libre rendant la réaction cyclol impossible ; toutefois, si ces reproches rendent l'hypothèse cyclol non-plausible, ils ne peuvent permettre d'affirmer qu'elle est fausse. Le modèle cyclol aura été la première structure bien décrite pour expliquer la structure des protéines globulaires : les protéines et les forces intermoléculaires étaient encore si mal connues qu'on ne pouvait se fonder sur ces remarques pour rejeter l'hypothèse. Celle-là, d'ailleurs, rendait compte de plusieurs propriétés communes aux protéines et expliquait certains paradoxes apparus lors d'expériences. Quoiqu’incorrecte dans sa forme générale, la théorie cyclol possédait certains aspects qui furent ensuite confirmés, comme l'existence de réactions cyclol ou le rôle des interactions hydrophobes dans le repliement des protéines. On peut comparer cette situation à celle du modèle de Bohr de l'atome d'hydrogène, qui parut d'abord peu plausible, même à son concepteur[86], et qui pourtant ouvrit la voie à la physique quantique. De même, Linus Pauling proposa un modèle détaillé de la géométrie de l'ADN[87] qui paraissait lui aussi fantaisiste mais qui stimula d'autres chercheurs[88],[89].
Réciproquement, l'hypothèse cyclol offre un exemple de théorie scientifique incorrecte, ayant malgré cela de belles propriétés de symétrie et une élégance formelle, qualités parfois regardées comme les apanages de théories scientifiques saines. Par exemple, le modèle de la double hélice de l'ADN de Crick et Watson[89] est parfois qualifié d'« évident » à cause des propriétés des liaisons par pont hydrogène et de sa symétrie ; néanmoins, dans des conditions d'ambiance particulières, il existe des structures d'ADN moins symétriques[90]. De même, Albert Einstein considérait que la théorie de la relativité générale n'avait pas besoin de confirmation experimentale ; et pourtant il a bien fallu l'amender pour la rendre compatible avec la théorie quantique des champs[91].
Notes modifier
- A Tiselius, « The Chemistry of Proteins and Amino Acids », Annual Review of Biochemistry, vol. 8, , p. 155–184 (DOI 10.1146/annurev.bi.08.070139.001103)
- Cf. T Svedberg, « Mass and size of protein molecules », Nature, vol. 123, no 3110, , p. 871 (DOI 10.1038/123871a0, Bibcode 1929Natur.123..871S)
- Cf. T. Svedberg, « Sedimentation of molecules in centrifugal fields », Chemical Reviews, vol. 14, , p. 1–15 (DOI 10.1021/cr60047a001)
- Cf. M Bergmann et Niemann C, « On the structure of proteins: cattle hemoglobin, egg albumin, cattle fibrin, and gelatin », Journal of Biological Chemistry, vol. 118, , p. 301–314
- Cf. T Svedberg, « The pH Stability Regions of Proteins », Transactions of the Faraday Society, vol. 26, , p. 741–744 (DOI 10.1039/TF9302600737)
- Cf. JS Fruton, « Early theories of protein structure », Annals of the New York Academy of Sciences, vol. 325, , p. 1–18 (PMID 378063, DOI 10.1111/j.1749-6632.1979.tb14125.x, Bibcode 1979NYASA.325....1F)
- Cf. F. Hofmeister, « Über Bau und Gruppierung der Eiweisskörper », Ergebnisse der Physiologie, vol. 1, , p. 759–802 (DOI 10.1007/BF02323641)
- E. Fischer, « Über die Hydrolyse der Proteinstoffe », Chemiker Zeitung, vol. 26, , p. 939–940
- Cf. E. Fischer, « Synthese von Depsiden, Flechtenstoffen und Gerbstoffen », Berichte der deutschen chemischen Gesellschaft, vol. 46, no 3, , p. 3253–3289 (DOI 10.1002/cber.191304603109)
- Cf. S.P.L. Sørensen, « The constitution of soluble proteins as reversibly dissociable component systems », Comptes rendus des travaux du Laboratoire Carlsberg, vol. 18, , p. 1–124
- D'après JS Fruton, Proteins, Enzymes, Genes : The Interplay of Chemistry and Biology, New Haven, CT, Yale University Press, (ISBN 0-585-35980-6)
- Cf. E Abderhalden, « Diketopiperazines », Naturwissenschaften, vol. 12, , p. 716–720 (DOI 10.1007/BF01504819, Bibcode 1924NW.....12..716A)
- Cf. E Abderhalden et E. Komm, « Über die Anhydridstruktur der Proteine », Zeitschrift für physiologische Chemie, vol. 139, , p. 181–204 (DOI 10.1515/bchm2.1924.139.3-4.181)
- K Linderstrøm-Lang, Hotchkiss RD et G. Johansen, « Peptide Bonds in Globular Proteins », Nature, vol. 142, no 3605, , p. 996 (DOI 10.1038/142996a0, Bibcode 1938Natur.142..996L)
- Cf. H. Chick et C.J. Martin, « On the "Heat" Coagulation of Proteins », Journal of Physiology, vol. 40, , p. 404–430 ; H Chick et C.J. Martin, « On the "Heat" Coagulation of Proteins. II. The Action of Hot Water upon Egg-albumen and the Influence of Acid and Salts upon Reaction Velocity », Journal of Physiology, vol. 43, , p. 1–27 ; H. Chick et C.J. Martin, « On the "Heat" Coagulation of Proteins. III. The Influence of Alkali upon Reaction Velocity », Journal of Physiology, vol. 45, , p. 61–69 ; Harriette Chick Chick et C.J. Martin, « On the "Heat" Coagulation of Proteins. IV. The Conditions controlling the Agglutination of Proteins already acted upon by Hot Water », Journal of Physiology, vol. 45, , p. 261–295
- Cf. ML Anson et Mirsky AE, « Protein Coagulation and Its Reversal », Journal of General Physiology, vol. 13, , p. 121–132
- Cf. M.L. Anson, « Protein Denaturation and the Properties of Protein Groups », Advances in Protein Chemistry, vol. 2, , p. 361–386 (ISBN 978-0-12-034202-0, DOI 10.1016/S0065-3233(08)60629-4)
- H Wu, « Studies on Denaturation of Proteins. XIII. A Theory of Denaturation », Chinese Journal of Physiology, vol. 5, , p. 321–344 Preliminary reports were presented before the XIIIth International Congress of Physiology at Boston (19–24 August 1929) and in the October 1929 issue of the American Journal of Physiology.
- Cf. A.E. Mirsky et Pauling L, « On the Structure of Native, Denatured, and Coagulated Proteins », Proceedings of the National Academy of Sciences of the United States of America, vol. 22, no 7, , p. 439–447 (DOI 10.1073/pnas.22.7.439, Bibcode 1936PNAS...22..439M)
- D’après H Neurath, Greenstein JP, F.W. Putnam et J.O. Erickson, « The Chemistry of Protein Denaturation », Chemical Reviews, vol. 34, no 2, , p. 157–265 (DOI 10.1021/cr60108a003)
- D’après F Putnam, « Protein Denaturation », The Proteins (H. Neurath and K. Bailey, eds.), vol. 1B, , p. 807–892
- Cf. W.T. Astbury et H.J. Woods, « The Molecular Weight of Proteins », Nature, vol. 127, no 3209, , p. 663–665 (DOI 10.1038/127663b0, Bibcode 1931Natur.127..663A)
- Cf. W.T. Astbury, « Some Problems in the X-Ray Analysis of the Structure of Animal Hairs and Other Protein Fibres », Transactions of the Faraday Society, vol. 29, no 140, , p. 193–211 (DOI 10.1039/tf9332900193)
- Cf. D. Jordan Lloyd, « Colloidal Structure and its Biological Significance », Biological Reviews, vol. 7, , p. 254–273 (DOI 10.1111/j.1469-185x.1962.tb01043.x)
- Cf. D. Jordan Lloyd et Marriott, « The swelling of protein fibres. Part II. Silk gut », Transactions of the Faraday Society, vol. 29, , p. 1228-1240 (DOI 10.1039/tf9332901228)
- Cf. WT Astbury, « Recent Advances In the X-Ray Study of Protein Fibres », Journal of the Textile Institute, vol. 27, , p. 282–297
- Dorothy M. Wrinch, « The Pattern of Proteins », Nature, vol. 137, no 3462, , p. 411–412 (DOI 10.1038/137411a0, Bibcode 1936Natur.137..411W)
- D'après DM Wrinch, « Energy of Formation of 'Cyclol' Molecules », Nature, vol. 138, no 3484, , p. 241–242 (DOI 10.1038/138241a0, Bibcode 1936Natur.138..241W)
- D'après FC Frank, « Energy of Formation of 'Cyclol' Molecules », Nature, vol. 138, no 3484, , p. 242 (DOI 10.1038/138242a0, Bibcode 1936Natur.138..242F)
- D'après Irving Langmuir et D.M. Wrinch, « Nature of the Cyclol Bond », Nature, vol. 143, no 3611, , p. 49–52 (DOI 10.1038/143049a0, Bibcode 1939Natur.143...49L)
- D'après Irving Langmuir, « The Structure of Proteins », Proceedings of the Physical Society, vol. 51, no 4, , p. 592–612 (DOI 10.1088/0959-5309/51/4/305, Bibcode 1939PPS....51..592L)
- D'après DM Wrinch, « On the Hydration and Denaturation of Proteins », Philosophical Magazine, vol. 25, , p. 705–739
- D'après D.M. Wrinch, « Hydration and Denaturation of Proteins », Nature, vol. 142, no 3588, , p. 260 (DOI 10.1038/142259a0, Bibcode 1938Natur.142..259.)
- RB Dow, J.E. Matthews et W.T.S. Thorp, « The Effect of High Pressure Treatment on the Physiological Activity of Insulin », American Journal of Physiology, vol. 131, , p. 382–387
- D'après W Kauzmann, « Some Factors in the Interpretation of Protein Denaturation », Advances in Protein Chemistry, vol. 14, , p. 1–63 (ISBN 978-0-12-034214-3, PMID 14404936, DOI 10.1016/S0065-3233(08)60608-7)
- DM Wrinch, « Structure of Proteins and of Certain Physiologically Active Compounds », Nature, vol. 138, no 3493, , p. 651–652 (DOI 10.1038/138651a0, Bibcode 1936Natur.138..651W)
- Cf. DM Wrinch et D. Jordan Lloyd, « The Hydrogen Bond and the Structure of Proteins », Nature, vol. 138, no 3496, , p. 758–759 (DOI 10.1038/138758a0, Bibcode 1936Natur.138..758W)
- Dorothy Maud Wrinch, « Nature of the Linkage in Proteins », Nature, vol. 139, no 3521, , p. 718 (DOI 10.1038/139718a0, Bibcode 1937Natur.139..718W)
- Cf. WT Astbury et Wrinch DM, « Intramolecular Folding of Proteins by Keto-Enol Interchange », Nature, vol. 139, no 3523, , p. 798 (DOI 10.1038/139798a0, Bibcode 1937Natur.139..798A)
- Cf. Dorothy Maud Wrinch, « The Fabric Theory of Protein Structure », Philosophical Magazine, vol. 30, , p. 64–67
- Dorothy M. Wrinch, « The Cyclol Theory and the 'Globular' Proteins », Nature, vol. 139, no 3527, , p. 972–973 (DOI 10.1038/139972a0, Bibcode 1937Natur.139..972W)
- Cf. Dorothy M. Wrinch, « The Native Protein », Science, vol. 106, no 2743, , p. 73–76 (PMID 17808858, DOI 10.1126/science.106.2743.73, Bibcode 1947Sci...106...73W)
- {Cf. Dorothy M. Wrinch, « On the Pattern of Proteins », Proceedings of the Royal Society, vol. A160, , p. 59–86 ; Dorothy M. Wrinch, « The Cyclol Hypothesis and the "Globular" Proteins », Proceedings of the Royal Society, vol. A161, , p. 505–524 ; Dorothy M. Wrinch, « On the Molecular Weights of the Globular Proteins », Philosophical Magazine, vol. 26, , p. 313–332
- Cf. Dorothy M. Wrinch, « The Tuberculin Protein TBU-Bovine (523) », Nature, vol. 144, no 3636, , p. 77 (DOI 10.1038/144077a0, Bibcode 1939Natur.144...77W)
- Cf. Dorothy M. Wrinch, « On the structure of pepsin », Philosophical Magazine, vol. 24, , p. 940
- Cf. Dorothy M. Wrinch, « Structure of Pepsin », Nature, vol. 142, no 3587, , p. 217 (DOI 10.1038/142215a0, Bibcode 1938Natur.142..215.)
- Cf. Dorothy M. Wrinch, « On the Structure of Insulin », Science, vol. 85, no 2215, , p. 566–567 (PMID 17769864, DOI 10.1126/science.85.2215.566, Bibcode 1937Sci....85..566W)
Cf. Dorothy M. Wrinch, « On the Structure of Insulin », Transactions of the Faraday Society, vol. 33, , p. 1368–1380 (DOI 10.1039/tf9373301368)
Cf. Dorothy M. Wrinch, « The Structure of the Insulin Molecule », Journal of the American Chemical Society, vol. 60, no 8, , p. 2005–2006 (DOI 10.1021/ja01275a514)
Cf. Dorothy M. Wrinch, « The Structure of the Insulin Molecule », Science, vol. 88, no 2276, , p. 148–149 (PMID 17751525, DOI 10.1126/science.88.2276.148-a, Bibcode 1938Sci....88..148W)
Cf. Dorothy M. Wrinch et Langmuir I, « The Structure of the Insulin Molecule », Journal of the American Chemical Society, vol. 60, no 9, , p. 2247–2255 (DOI 10.1021/ja01276a062)
Cf. Irving Langmuir et D.M. Wrinch, « A Note on the Structure of Insulin », Proceedings of the Physical Society, vol. 51, no 4, , p. 613–624 (DOI 10.1088/0959-5309/51/4/306, Bibcode 1939PPS....51..613L) - Cf. WL Bragg, « Patterson Diagrams in Crystal Analysis », Nature, vol. 143, no 3611, , p. 73–74 (DOI 10.1038/143073a0, Bibcode 1939Natur.143...73B) ; John D. Bernal, « Vector Maps and the Cyclol Hypothesis », Nature, vol. 143, no 3611, , p. 74–75 (DOI 10.1038/143074a0, Bibcode 1939Natur.143...74B) ; JM Robertson, « Vector Maps and Heavy Atoms in Crystal Analysis and the Insulin Structure », Nature, vol. 143, no 3611, , p. 75–76 (DOI 10.1038/143075a0, Bibcode 1939Natur.143...75R)
- Cf. DP Riley et Fankuchen I, « A Derived Patterson Analysis of the Skeleton of the Cyclol C2 Molecule », Nature, vol. 143, no 3624, , p. 648–649 (DOI 10.1038/143648a0, Bibcode 1939Natur.143..648R) ; Cf. Dorothy M. Wrinch, « Patterson Projection of the Skeletons of the Structure proposed for the Insulin Molecule », Nature, vol. 145, no 3687, , p. 1018 (DOI 10.1038/1451018a0, Bibcode 1940Natur.145.1018W) ; D Riley, « A Patterson Analysis derived from the Cyclol C2 Skeleton », Nature, vol. 146, no 3694, , p. 231 (DOI 10.1038/146231a0, Bibcode 1940Natur.146..231R)
- D'après H. Neurath et H.B. Bull, « The Surface Activity of Proteins », Chemical Reviews, vol. 23, no 3, , p. 391–435 (DOI 10.1021/cr60076a001)
- D'après M Huggins, « The Structure of Proteins », Journal of the American Chemical Society, vol. 61, no 3, , p. 755 (DOI 10.1021/ja01872a512)
- D'après F. Haurowitz, « The arrangement of peptide chains in sphaero protein-molecules », Zeitschrift der physiologischen Chemie, vol. 256, , p. 28–32
- D'après KH Meyer et Hohenemser W, « Possibility of the Formation of Cyclols from Simple Peptides », Nature, vol. 141, no 3582, , p. 1138–1139 (DOI 10.1038/1411138b0, Bibcode 1938Natur.141.1138M)
- D'après M Bergmann et C. Niemann, « The Chemistry of Amino Acids and Proteins », Annual Review of Biochemistry, vol. 7, , p. 99–124 (PMCID 537431, DOI 10.1146/annurev.bi.07.070138.000531)
- D'après A. Neuberger, « Chemical criticism of the cyclol and frequency hypothesis of protein structure », Proceedings of the Royal Society, vol. 170, , p. 64–65
- D'après A Neuberger, « Chemical Aspects of the Cyclol Hypothesis », Nature, vol. 143, no 3620, , p. 473 (DOI 10.1038/143473a0, Bibcode 1939Natur.143..473N)
- D'après F. Haurowitz et Astrup T, « Ultraviolet absorption of genuine and hydrolysed protein », Nature, vol. 143, no 3612, , p. 118–119 (DOI 10.1038/143118b0, Bibcode 1939Natur.143..118H)
- D'après IM Klotz et P. Griswold, « Infrared Spectra and the Amide Linkage in a Native Globular Protein », Science, vol. 109, no 2830, , p. 309–310 (PMID 17782718, DOI 10.1126/science.109.2830.309, Bibcode 1949Sci...109..309K)
- D'après L Pauling et Niemann C, « The Structure of Proteins », Journal of the American Chemical Society, vol. 61, no 7, , p. 1860–1867 (DOI 10.1021/ja01876a065)
- D'après RD Hotchkiss, « The Determination of Peptide Bonds in Crystalline Lactoglobulin », Journal of Biological Chemistry, vol. 131, , p. 387–395
- Cf. Dorothy Maud Wrinch, « The Geometrical Attack on Protein Structure », Journal of the American Chemical Society, vol. 63, no 2, , p. 330–33 (DOI 10.1021/ja01847a004)
- Cf. DM Wrinch, « The Cyclol Hypothesis », Nature, vol. 145, no 3678, , p. 669–670 (DOI 10.1038/145669a0, Bibcode 1940Natur.145..669W)
- Cf. DM Wrinch, « The Native Proteins as Polycondensations of Amino Acids », Science, vol. 107, no 2783, , p. 445–446 (PMID 17844448, DOI 10.1126/science.107.2783.445-a)
- Cf. DM Wrinch, « Skeletal Units in Protein Crystals », Science, vol. 115, no 2987, , p. 356–357 (PMID 17748855, DOI 10.1126/science.115.2987.356, Bibcode 1952Sci...115..356W)
- Cf. DM Wrinch, « Molecules of the Insulin Structure », Science, vol. 116, no 3021, , p. 562–564 (DOI 10.1126/science.116.3021.562, Bibcode 1952Sci...116..562W)
- Cf. Dorothy M. Wrinch, « The Structure of the Globular Proteins », Nature, vol. 143, no 3620, , p. 482–483 (DOI 10.1038/143482a0, Bibcode 1939Natur.143..482W)
- Cf. Dorothy Maud Wrinch, « The Cyclol Theory and the Structure of Insulin », Nature, vol. 143, no 3627, , p. 763–764 (DOI 10.1038/143763a0, Bibcode 1939Natur.143..763W)
- Cf. Dorothy Maud Wrinch, « Native Proteins, Flexible Frameworks and Cytoplasmic Organization », Nature, vol. 150, no 3800, , p. 270–271 (DOI 10.1038/150270a0, Bibcode 1942Natur.150..270W)
- Cf. GA Anslow, « Bond Energies in Some Protein Fabrics and Side Chains », Physical Review, vol. 61, nos 7–8, , p. 547 (DOI 10.1103/PhysRev.61.541, Bibcode 1942PhRv...61..541.)
- Cf. GA Anslow, « Ultraviolet Spectra of Biologically Important Molecules », Journal of Applied Physics, vol. 16, , p. 41–49 (DOI 10.1063/1.1707499, Bibcode 1945JAP....16...41A)
- Cf. GA Anslow, « The Sites of the Amino-Acid Residues on a Cyclol Model of Insulin », Journal of Chemical Physics, vol. 21, no 11, , p. 2083–2084 (DOI 10.1063/1.1698765, Bibcode 1953JChPh..21.2083A)
- Cf. T. Guedez, A. Núñez, E. Tineo et O. Núñez, « Ring size configuration effect and the transannular intrinsic rates in bislactam macrocycles », Journal of the Chemical Society, Perkin Transactions 2, vol. 2002, no 12, , p. 2078–2082 (DOI 10.1039/b207233e)
- Cf. John D. Bernal, « Structure of proteins », Nature, vol. 143, no 3625, , p. 663–667 (DOI 10.1038/143663a0, Bibcode 1939Natur.143..663B)
- D'après T. Wieland et M. Bodanszky, The World of Peptides, Springer Verlag (ISBN 978-0-387-52830-4 et 0-387-52830-X), p. 193–198
- Cf. A Hofmann, H. Ott, R. Griot, P.A. Stadler et A.J. Frey, « Synthese von Ergotamin », Helvetica Chimica Acta, vol. 46, , p. 2306–2336 (DOI 10.1002/hlca.19630460650)
- Cf. MM Shemyakin, Antonov VK et Shkrob AM, « Activation of the amide group by acylation », Peptides, Proc. 6th Europ. Pept. Symp., Athens, , p. 319–328
- Cf. G Zanotti, Pinnen F, Lucente G, Cerrini S, Fedeli W et Mazza F, « Peptide thiacyclols. Synthesis and structural studies », J. Chem. Soc. Perkin Trans., vol. 1, , p. 1153–1157 (DOI 10.1039/p19840001153)
- Cf. RG Griot et Frey AJ, « The formation of cyclols from N-hydroxyacyl lactames », Tetrahedron, vol. 19, no 11, , p. 1661–1673 (DOI 10.1016/S0040-4020(01)99239-7)
- Cf. G Lucente et Romeo A, « Synthesis of cyclols from small peptides via amide-amide reaction », Chem. Commun., vol. ?, , p. 1605–1607 (DOI 10.1039/c29710001605) ; M. Rothe, W. Schindler, R. Pudill, U. Kostrzewa, R. Theyson et R. Steinberger, « Zum Problem der Cycloltripeptidsynthese », Peptides, Proc. 11th Europ. Pept. Symp., Wien, , p. 388–399. ; M. Rothe et K.L. Roser, Abstr. 20th Europ. Pept. Symp. Tübingen, , « Conformational flexibility of cyclic tripeptides », p. 36.
- T. Wieland et H. Mohr (1956) "Diacylamide als energiereiche Verbindungen. Diglycylimid", Liebigs Ann. Chem., 599, 222–232. ; Wieland T et Urbach H. (1958) "Weitere Di-Aminoacylimide und ihre intramolekulare Umlagerung", Liebigs Ann. Chem., 613, 84–95. ; M. Brenner, « The aminoacyl insertion », Ciba Foundation Symposium on Amino acids and peptides with antimetabolic activity, Wolstenholme GEW et O'Connor CM, eds., Churchill,
- Cf. Dorothy M. Wrinch, « Structure of Bacitracin A », Nature, vol. 179, no 4558, , p. 536–537 (DOI 10.1038/179536a0, Bibcode 1957Natur.179..536W) ; Dorothy M. Wrinch, « An Approach to the Synthesis of Polycyclic Peptides », Nature, vol. 180, no 4584, , p. 502–503 (DOI 10.1038/180502b0, Bibcode 1957Natur.180..502W) ; Dorothy M. Wrinch, « Some Issues in Molecular Biology and Recent Advances in the Organic Chemistry of Small Peptides », Nature, vol. 193, no 4812, , p. 245–247 (PMID 14008494, DOI 10.1038/193245a0, Bibcode 1962Natur.193..245W) ; Dorothy M. Wrinch, « Recent Advances in Cyclol Chemistry », Nature, vol. 199, no 4893, , p. 564–566 (DOI 10.1038/199564a0, Bibcode 1963Natur.199..564W) ; Dorothy M. Wrinch, « A Contemporary Picture of the Chemical Aspects of Polypeptide Chain Structures and Certain Problems of Molecular Biology », Nature, vol. 206, no 4983, , p. 459–461 (PMID 5319104, DOI 10.1038/206459a0, Bibcode 1965Natur.206..459W)
- Dorothy M. Wrinch, Chemical Aspects of the Structures of Small Peptides : An Introduction, Copenhague, Munksgaard,
- Dorothy M. Wrinch, Chemical Aspects of Polypeptide Chain Structures and the Cyclol Theory, New York, Plenum Press,
- Cf. W. Kauzmann, « Reminiscences from a life in protein physical chemistry », Protein Science, vol. 2, no 4, , p. 671–691 (PMID 8518739, PMCID 2142355, DOI 10.1002/pro.5560020418)
- D'après C. Tanford et Reynolds J, Nature's robots : A history of proteins, Oxford, Oxford University Press, (ISBN 0-19-850466-7)
- (en) Abraham Pais, Inward bound : of matter and forces in the physical world, Oxford/New York, Oxford University Press, , 666 p. (ISBN 0-19-851971-0) ; Niels Bohr, « On the Constitution of Atoms and Molecules (Part 1 of 3) », Philosophical Magazine, vol. 26, , p. 1–25 (lire en ligne) ; Niels Bohr, « On the Constitution of Atoms and Molecules, Part II Systems Containing Only a Single Nucleus », Philosophical Magazine, vol. 26, no 153, , p. 476–502 (DOI 10.1080/14786441308634993) ; Niels Bohr, « On the Constitution of Atoms and Molecules, Part III », Philosophical Magazine, vol. 26, , p. 857–875 (DOI 10.1080/14786441308635031) ; Niels Bohr, « The spectra of helium and hydrogen », Nature, vol. 92, no 2295, , p. 231–232 (DOI 10.1038/092231d0, Bibcode 1913Natur..92..231B)
- Linus Pauling et R.B. Corey, « A Proposed Structure For The Nucleic Acids », Proceedings of the National Academy of Sciences, vol. 39, no 2, , p. 84–97 (PMID 16578429, PMCID 1063734, DOI 10.1073/pnas.39.2.84, Bibcode 1953PNAS...39...84P)
- Cf. Rosalind Franklin et R. Gosling, « Molecular configuration of sodium thymonucleate », Nature, vol. 171, no 4356, , p. 740–741 (PMID 13054694, DOI 10.1038/171740a0, Bibcode 1953Natur.171..740F)
- Cf. James D. Watson et Francis Crick, « Molecular structure of nucleic acids: A structure for deoxyribonucleic acid », Nature, vol. 171, no 4356, , p. 737–738 (PMID 13054692, DOI 10.1038/171737a0, Bibcode 1953Natur.171..737W)
- Cf. W. Saenger, Principles of Nucleic Acid Structure, Springer Verlag, (ISBN 0-387-90762-9)
- A. Pais, Subtle is the Lord : The Science and the Life of Albert Einstein, Oxford University Press, (ISBN 0-19-853907-X)
Pour en savoir plus modifier
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cyclol » (voir la liste des auteurs).
- « Protein Units Put in Graphic 'Cage' », New York Times, , p. 14.
- « Waffle-Iron Theory of Proteins », New York Times, , E9.
- Marjorie Senechal, Structures of Matter and Patterns in Science, inspired by the work and life of Dorothy Wrinch, 1894–1976, Smith College, Northampton, Massachusetts, Schenkman Publishing Company, .
- "Selected papers of Dorothy Wrinch, from the Sophia Smith Collection", in Structures of Matter and Patterns in Science.
- Marjorie Senechal, I Died For Beauty : Dorothy Wrinch and the Cultures of Science, Oxford University Press, .