Anaplasma phagocytophilum
Anaplasma phagocytophilum (anciennement Ehrlichia phagocytophilum)[1] est une bactérie à Gram négatif dotée d'une attirance (tropisme) inhabituelle pour les neutrophiles (elle ne peut se reproduire que dans les neutrophiles) et capable de déjouer le système immunitaire de son hôte grâce à un mécanisme d'adaptation et pathogénique unique[2].
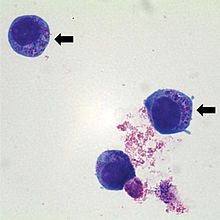
Cette bactérie est l'agent des anaplasmoses ovine et bovine (transmise par des tiques), aussi dénommées « fièvre des pâturages », et elle provoque aussi la maladie zoonotique anaplasmose granulocytaire humaine[3].
Biologie modifier
A. phagocytophilum est une petite bactérie (intracellulaire obligatoire) à paroi cellulaire à Gram négatif.
Elle mesure 0,2–1,0 μm, et ne possède pas de mécanisme de biosynthèse des lipopolysaccharides.
La bactérie réside d'abord dans un endosome précoce, où elle acquiert des nutriments pour la fission binaire, et elle se développe en petits groupes (dits morulae).
Cette bactérie a une préférence marquée pour les cellules myéloïdes ou granulocytaires[2].
Rôle dans la maladie humaine modifier
Bien que ce pathogène était connu comme agent de maladies vétérinaires depuis 1932, ce n'est qu'en 1990 qu' A. phagocytophilum a été reconnu comme agent d'une zoonose dénommée anaplasmose granulocytaire humaine (AGH ou HGA pour les anglophones). Cette maladie a été identifiée pour la première fois chez un patient du Wisconsin décédé d'une grave maladie fébrile deux semaines après une piqûre de tique. Au cours de la dernière étape de l'infection, un groupe de petites bactéries a été observé dans les polynucléaires neutrophiles de son sang.
Depuis 1990, l'incidence des HGA a augmenté et elle est maintenant reconnue dans toute l'Europe.
Les symptômes incluent fièvre, maux de tête, leucopénie, thrombocytopénie et légère lésion du foie ; sans éruption cutanée[2].
Signes cliniques chez l'animal modifier
La maladie est multisystémique, avec comme changements les plus graves[3] :
- l'anémie
- la leucopénie
- d'autres symptômes, pouvant évoquer ceux de la maladie de Lyme, autre maladie transmise par les tiques (et pouvant d'ailleurs parfois aussi avoir été simultanément transmise par la tique, en co-infection)
- léthargie
- ataxie
- perte d'appétit
- boiterie, membres et articulations faibles et/ou douloureux, (pouvant aussi faire évoquer une arthrite de Lyme)[3].
La maladie est zoonotique (pouvant être transmise à l'Homme, a priori toujours via une transmission vectorielle) ; la morula peut être visualisée dans les neutrophiles infectés (le neutrophile est un type de globule blanc) dans le sang périphérique mais aussi dans le liquide synovial.
Mécanisme de reproduction modifier
A. phagocytophilum se lie aux protéines d'échafaudage fucosylées et sialylées sur les surfaces des neutrophiles et des granulocytes. On sait qu'un appareil de sécrétion de type IV est aide au transfert de molécules entre la bactérie et l'hôte. Le ligand le plus étudié est PSGL-1 (CD162). La bactérie adhère à PSGL-1 (CD162) à travers une protéine de surface majeure de 44 kDa (Msp2).
Après l'entrée de la bactérie dans la cellule, l'endosome arrête la maturation et n'accumule pas de marqueurs d'endosomes ou de phagolysosomes tardifs. Pour cette raison, la vacuole ne s'acidifie pas ni ne fusionne aux lysosomes.
A. phagocytophilum se divise ensuite jusqu'à la lyse des cellules ou quand les bactéries quittent la cellule infectée pour aller en infecter d'autres[2].
Contournement du système immunitaire modifier
Cette bactérie peut modifier et détourner la fonction des neutrophiles à son avantage. Elle peut survivre à la première rencontre avec la cellule hôte en détoxifiant le superoxyde produit par l'assemblage des neutrophiles phagocytes oxydases.
Elle perturbe notamment des fonctions normales des neutrophiles, telles que l'adhésion des cellules endothéliales, la transmigration, la motilité, la dégranulation, l'éclatement respiratoire et la phagocytose[2].
Elle provoque enfin une augmentation de la sécrétion de l'IL-8 (un chimioattracteur) qui augmente la phagocytose des neutrophiles, ici dans le but d'augmenter la dissémination bactérienne dans d'autres neutrophiles[4].
Diagnostic (test) de laboratoire modifier
Ces tests permettent de confirmer l'infection à A. phagocytophilum[5] :
Le plus utilisé est le test d'immunofluorescence indirecte ; les échantillons de sérum prélevés en phase aiguë ou de convalescente peuvent ainsi être évalués pour rechercher un changement du titre d'anticorps pour A. phagocytophilum.
Les inclusions intracellulaires (morulae) peuvent être visualisées dans les granulocytes sur des frottis sanguins colorés par Wright ou Giemsa-.
Les tests de PCR (réaction en chaîne par polymérase) sont utilisés pour détecter la présence d'ADN d'A. Phagocytophilum.
Antibiothérapie modifier
Les patients victimes d'Anaplasmose sont généralement traités par la doxycycline (100 mg deux fois par jour jusqu'à ce que la fièvre du patient diminue pendant au moins 3 jours).
Ce médicament a été le plus bénéfique pour les patients infectés par la bactérie. D'autres médicaments, à base de tétracycline sont également efficaces.
Les patients présentant des symptômes d'HGA et de fièvre inexpliquée après une exposition aux tiques devraient recevoir un traitement empirique à la doxycycline pendant que leurs tests de diagnostic sont en attente, surtout s'ils présentent une leucopénie et/ou une thrombocytopénie[5].
Chez les animaux, d'autres antibiotiques ont été utilisés (oxytétracycline, sulfaméthazine, sulfhadimidine, doxycycline et triméthoprime-sulfonamides[3]9.
Voir aussi modifier
Articles connexes modifier
Bibliographie modifier
Notes et références modifier
- Dumler JS, Barbet AF, Bekker CP, « Reorganization of genera in the families Rickettsiaceae and Anaplasmataceae in the order Rickettsiales: unification of some species of Ehrlichia with Anaplasma, Cowdria with Ehrlichia and Ehrlichia with Neorickettsia, descriptions of six new species combinations and designation of Ehrlichia equi and 'HGE agent' as subjective synonyms of Ehrlichia phagocytophila », Int. J. Syst. Evol. Microbiol., vol. 51, no Pt 6, , p. 2145–65 (PMID 11760958, DOI 10.1099/00207713-51-6-2145)
- (en) Dumler JS, Choi KS, Garcia-Garcia JC, « Human granulocytic anaplasmosis and Anaplasma phagocytophilum », Emerging Infect. Dis., vol. 11, no 12, , p. 1828–34 (PMID 16485466, PMCID 3367650, DOI 10.3201/eid1112.050898)
- Tick-Borne Fever reviewed and published by WikiVet, accessed 12 October 2011.
- Thomas V, Fikrig E, « Anaplasma phagocytophilum specifically induces tyrosine phosphorylation of ROCK1 during infection », Cell. Microbiol., vol. 9, no 7, , p. 1730–7 (PMID 17346310, DOI 10.1111/j.1462-5822.2007.00908.x)
- « Human Anaplasmosis Information for Health Professionals: Diagnostic tests », sur Diseases, Minnesota Department of Health
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Anaplasma phagocytophilum » (voir la liste des auteurs).