Acide quisqualique
composé chimique
| Acide quisqualique | |
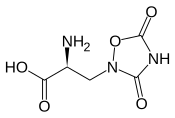 Structure de l'acide quisqualique |
|
| Identification | |
|---|---|
| Nom UICPA | acide (2S)-2-amino-3-(3,5-dioxo-1,2,4-oxadiazolidin-2-yl)propanoïque |
| No CAS | |
| No ECHA | 100.164.809 |
| PubChem | 40539 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H7N3O5 |
| Masse molaire[1] | 189,126 2 ± 0,006 6 g/mol C 31,75 %, H 3,73 %, N 22,22 %, O 42,3 %, |
| Précautions | |
| SGH[2] | |
| H302, H312, H332 et P280 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acide quisqualique est un agoniste des récepteurs AMPA et des récepteurs du glutamate métabotropes (en)[3],[4],[5]. Il est excitotoxique et est utilisé en neuroscience pour détruire sélectivement les neurones dans le cerveau et la moelle épinière[6],[7],[8]. On le trouve naturellement dans les graines des espèces de Quisqualis, telles que Quisqualis indica.
Des études réalisées par l'Agricultural Research Service du département de l’Agriculture des États-Unis ont montré qu'il est également présent dans les pétales des fleurs de pélargoniums et paralyserait le scarabée japonais. On pense qu'il agit en mimant l'acide L-glutamique, qui est un neurotransmetteur de la plaque motrice des insectes et du système nerveux central des mammifères.
Notes et références modifier
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Quisqualic acid powder, consultée le 22 février 2014.
- (en) Rongsheng Jin, Michelle Horning, Mark L. Mayer et Eric Gouaux, « Mechanism of Activation and Selectivity in a Ligand-Gated Ion Channel: Structural and Functional Studies of GluR2 and Quisqualate », Biochemistry, vol. 41, no 52, , p. 15635-15643 (lire en ligne) DOI 10.1021/bi020583k ;
- (en) Donghui Kuang, David R. Hampson, « Ion dependence of ligand binding to metabotropic glutamate receptors », Biochemical and Biophysical Research Communications, vol. 345, no 1, , p. 1-6 (lire en ligne) DOI 10.1016/j.bbrc.2006.04.064 ;
- (en) Wei Zhang, Antoine Robert, Stine B. Vogensen et James R. Howe, « The Relationship between Agonist Potency and AMPA Receptor Kinetics », Biophysical Journal, vol. 91, no 4, , p. 1336-1346 (lire en ligne) DOI 10.1529/biophysj.106.084426 ;
- (en) Janice L. Muir, Keith J. Page, D.J.S. Sirinathsinghji, Trevor W. Robbins et Barry J. Everitt, « Excitotoxic lesions of basal forebrain cholinergic neurons: Effects on learning, memory and attention », Behavioural Brain Research, vol. 57, no 2, , p. 123-131 (lire en ligne) DOI 10.1016/0166-4328(93)90128-D ;
- (en) L. Giovannelli, F. Casamenti et G. Pepeu, « C-fos expression in the rat nucleus basalis upon excitotoxic lesion with quisqualic acid: a study in adult and aged animals », Journal of Neural Transmission, vol. 105, nos 8-9, , p. 935-948 (lire en ligne) DOI 10.1007/s007020050103 ;
- (en) Jeung Woon Lee, Orion Furmanski, Daniel A. Castellanos, Linda A. Daniels, Aldric T. Hama et Jacqueline Sagen, « Prolonged nociceptive responses to hind paw formalin injection in rats with a spinal cord injury », Neuroscience Letters, vol. 439, no 2, , p. 212-215 (PMCID 2680189, lire en ligne) DOI 10.1016/j.neulet.2008.05.030 ;
